| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Microscopie - potentialul de actiune |
Microscopie - potentialul de actiune
Microscopie - Potentialul de actiune
I. Notiuni teoretice
In starea normala (numita stare de repaus) membrana celulara este polarizata, avand fata interna mai negativa decat cea externa. In mod uzual se ia fata interna drept referinta.
Potentialul de membrana, Vm numit potential de repaus, ia valori de la minus cativa milivolti, pentru majoritatea celulelor, pana la -60mV pentru axo1ema, -90mV pentru sarcolema si chiar -200mV pentru membranele, celulelor din organul electric al pestelui torpila, Torpedo californicum.
Figura 7.1 prezinta ceea ce se intampla cand axolema este excitata de un stimul electric depolarizant. Daca depolarizarea depaseste o valoare critica (sau liminara), atunci membrana se depolarizeaza in continuare din proprie initiativa (pana la 0mV) si chiar se repolarizeaza dar in sens contrar pana pe la +50mV. Apoi potentialul initial este restaurat.
Aceasta oscilatie de tensiune de circa 120mV in amplitudine si 1ms durata se numeste potential de actiune. Depolarizarea externa este de fapt doar un declansator (trigger) al fenomenului intrucat energia raspunsului specific al membranei provine de la metabolismul celular si nu de la stimul.
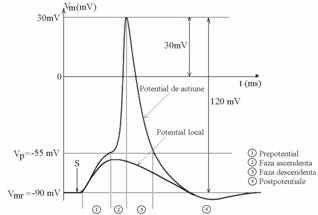
Figura 7.1. Simularea potentialului actiune.
Dupa potentialul de actiune apar o serie de oscilatii mici si lente, numite postpotentiale (pozitive si negative, in functie de sensul depasirii potentialului de repaus). In timpul potentialului de actiune, membrana este complet inexcitabila (perioada refractara absoluta). Pe durata derularii postpotentialelor, membrana este mai putin excitabila decat in mod normal (perioada refractara relativa). Membrana are nevoie de aproximativ zece durate ale potentialului de actiune, fara nici un stimul pentru a-si reface complet potentialul de repaus si excitabilitatea anterioara.
Potentialul de actiune se propaga fara decrement (atenuare) in lungul axonului sub forma asa-numitului impuls nervos. Impulsul nervos satisface legea totul-sau-nimic, ceea ce inseamna ca nici un fel de excitatie nu se transmite daca stimulul are o valoare inferioara pragului de excitabilitate, si nici o modificare ca forma, amplitudine si durata nu apare daca stimulul este superior pragului. Pragul depinde de ampli-tudinea, durata, frecventa si forma stimulului. Influenta frecventei devine importanta peste 1000Hz, cand excitabilitatea descreste rapid daca frecventa de stimulare creste. La frecvente joase (sub 100Hz) nu se observa nici o modificare a potentialului de actiune.
Un stimul cu o rampa mai lunga, da posibilitatea membranei sa se acomodeze la excitatie si sa isi refaca (cel putin partial) starea perturbata de depolarizare, deci sa isi scada excitabilitatea. Scurtarea timpului de stabilire a pulsului depolarizant lasa nemodificata capacitatea de reactie a membranei. In cele ce urmeaza se considera numai pulsuri rectangulare.
|
Pentru astfel de stimuli, caracteristicile de prag, adica intensitatea liminara I (indiferent de natura pulsului: tensiune sau curent electric, soc mecanic, chimic, etc.) si durata liminala t satisfac legea intensitate-durata:
![]()
reprezentata grafic in figura 7.2. Legea este de tip hiperbolic si are doua asimptote: una verticala si una orizontala.
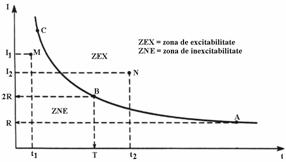
Figura 7.2. Legea intensitate-durata pentru un puls rectangular
Intensitatea minima a unui stimul rectangular ce excita membrana (avand o durata infinita) se numeste reobaza (notata cu R).
![]()
Cea mai mica durata a unui puls rectangular, cu amplitudinea egala cu dublul reobazei, care inca excita membrana, a fost denumit cronaxie (t). Cronaxia este cea mai utilizata marime in caracterizarea excitabilitatii unui tesut. Cu cat este mai mica cronaxia, cu atat mai mare este excitabilitatea membranei. O membrana mai excitabila are nevoie de mai putina energie de stimulare.
Cronaxia poate fi determinata inlocuind valoarea intensitatii I=2A (A=R) in legea intensitate-durata:
![]() tR
tR
Se poate rescrie acum legea prin inlocuirea constantelor A si B:
![]()
Reobaza si cronaxia depind de actiunea unor chimicale: hormoni, toxine, anestezice etc., ce pot fi utilizate in scop medical, atat in diagnostic cat si in terapie. Uneori este necesara cresterea excitabilitatii, alteori, din contra, este nevoie sa fie scazuta. Din aceasta cauza studiile electrofiziologice ale efectelor unor liganzi asupra bioelectrogenezei membranei sunt o practica curenta de peste un secol.
Au fost facute numeroase incercari de explicare a potentialului de actiune. Cea mai productiva pentru o lunga perioada de timp (fapt pentru care e considerata clasica) a fost Teoria ionica, propusa intre 1949-1952 de doi cercetatori britanici, laureati ai Premiului Nobel pentru medicina in 1963, Hodgkin si Huxley.
Considerand ca
exista blocanti diferiti pentru cele mai importante fluxuri ionice "active" (TTX pentru Na+ si TEA pentru K+),
membrana celulara este un dielectric (izolator) ce separa doua medii conductive (citoplasma si lichidul interstitial sunt electroliti),
axonul perfuzat cu solutie salina izotona, avand aceleasi concentratii de sodiu, potasiu si clor ca si axoplasma, are o comportare electrica similara celui integral, deci impulsul nervos este un fenomen de membrana,
Hodgkin si Huxley au propus modelul electric al membranei prezentat in figura 7.3 si teoria aferenta lui.
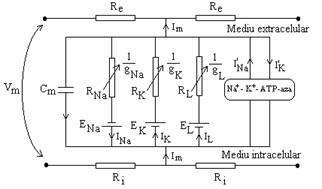
Figura 7.3. Circuitul echivalent al unei portiuni de membrana axonala
Citoplasma si lichidul interstitial, medii conductoare, sunt reprezentate prin rezistori electrici conectati in serie. Membrana este conceputa ca fiind compusa din "celule" electrice independente.
Fiecare "celula" contine un condensator si trei ramuri pentru transportul selectiv al ionilor: una pentru sodiu, una pentru potasiu, si una de "scurgere" pentru toti ceilalti ioni la un loc.
Din cauza gradientilor de activitate chimica a ionilor implicati intre cele doua fete ale membranei, fiecare ramura contine o baterie Nerst, a carei forta electromotoare "E" este proportionala cu logaritmul raportului activitatilor chimice.
Conductantele ionice selective sunt reprezentate de rezistori, a caror rezistenta poate varia datorita unui puls de tensiune a membranei sau/si actiunea unor liganzi.
Efectul TTX
Adaugarea de tetrodotoxina, TTX (o neurotoxina puternica extrasa din ficatul si ovarele unui peste din Marea Japoniei, Sphoeroides rubripes, si unii tritoni), in solutia de imersie a axonului, blocheaza transportul de sodiu si nu are efecte directe notabile asupra transportului de potasiu.
Figura 7.4 prezinta efectul TTX asupra probabilitatilor n, m, h, a conductantelor de sodiu si potasiu, a potentialului de actiune. Toxina are nevoie de ceva timp pentru a difuza in structura si a da efect. Cand conductanta maxima a sodiului scade sub o valoare critica, membrana nu mai raspunde.
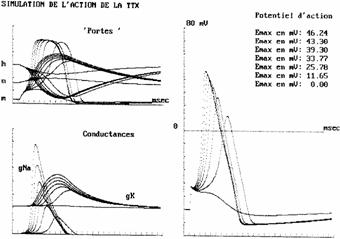
Figura 7.4. Efectul TTX.
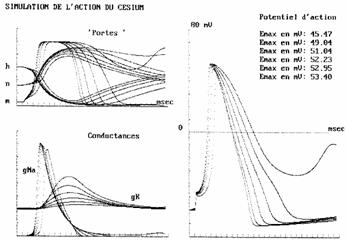
Figura 7.5. Efectul cesiului asupra bioelectrogenezei membranei.
Efectul cesiului
Datorita competitiei la legarea de componentele proteice ale membranei cu ceilalti cationi monovalenti (in special cu ionii de K+) prezenta cesiului in solutia de imersie afecteaza dinamica probabilitatilor n, m si h si duce la o scadere semnificativa a conductantei superficiale a potasiului si la o foarte mica crestere a conductantei de sodiu. Aceste schimbari modifica potentialul de actiune, crescandu-i putin durata dupa cum se observa in figura 7.5.
II. Parte experimentala
Utilizand programul de simulare din dotarea laboratorului de biofizica sa se determine valoarea reobazei, a cronaxiei, perioadei refractare si sa se urmareasca efectele TTX si Cs. Comentati rezultatele obtinute.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||