
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Electroforeza |
Electroforeza
Electroforeza
Reprezinta metoda de separare bazata pe migrarea sub influenta campului electric a substantelor incarcate cu sarcina electrica.
Eletroforeza poate fi folosita atat in scop analitic (separarea componentilor si dozarea lor), preparativ (obtinerea unor componenti in stare pura) dar si ca metoda de studiu a proprietatilor superficiale ale unor celule sau organite celulare.
O particula incarcata electric, cand este dizolvata sau suspendata intr-un mediu lichid, sub influenta unui camp electric uniform, atinge o viteza constanta de migrare. Speciile incarcate pozitiv se vor indrepta catre catod, iar speciile incarcate negativ catre anod. Viteza de migrare a ambelor specii va fi determinata de fortele care actioneaza asupra lor. Aceste forte sunt:
-
forta de atractie electroforetica: ![]()
-
forta de frecare Stokes: ![]()
-
forta de franare electroforetica:
![]()
forta ![]() datorata efectului de
relaxare
datorata efectului de
relaxare
Imediat dupa aplicarea campului electric, suma vectoriala a acestor patru forte este egala cu zero si viteza electroforetica devine constanta (figura 4.3). Neglijand efectul de relaxare si tinand cont de directiile celor trei forte se obtine viteza electroforetica:
![]()
unde: - ε = permitivitatea absoluta a mediului
- ξ = potentialul electrocinetic
- E = intensitatea campului electric
- η = coeficientul de vascozitate
Mobilitatea electroforetica se defineste ca raportul dintre viteza si intensitatea campului electric:
![]()
Datorita incarcarii electrice nete de la suprafata particulelor biologice, in acesta regiune se organizeaza, se structureaza, un strat dublu electric alcatuit dintr-o zona compacta de grosime (a) si una difuza, in care pentru simplitate, suprafata de demarcare a particulei fata de mediu este considerata plana (figura 4.3).
Cand particula este pusa in miscare de catre campul electric aplicat, aceasta antreneaza o data cu ea un strat de lichid mai gros decat cel compact, notat cu (b). Planul care se afla la distanta b>a de particula se numeste plan hidrodinamic de alunecare, iar potentialul in acest plan se numeste potential electrocinetic (ξ). Valoarea potentialului electro-cinetic se poate determina indirect pe baza masurarii mobilitatii electroforetice a particulei in camp electric.
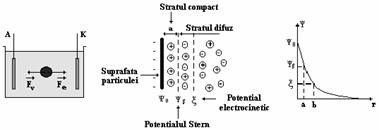
Figura 4.3. Fortele ce actioneaza asupra unei particule incarcate cu sarcina electrica suspendata intr-un mediu lichid. Distributia ionilor in stratul dublu electric de la suprafata unei particule scufundate intr-un electrolit.
Metoda microscopica de electroforeza - acesta metoda este singura tehnica disponibila pentru determinarea vitezei electroforetice a particulelor mari, cum ar fi celulele sanguine, microorganisme, particule coloidale, etc. Se bazeaza pe observarea directa, la microscop a migrarii particulelor suspendate intr-o solutie tampon adecvata ca urmare a aplicarii unui camp electric creat de un curent continuu.
|
Pentru aceasta tehnica este necesara o celula electroforetica (figura 4.4), prevazuta cu doi electrozi, un sistem de umplere si golire, ce se poate introduce in campul unui microscop. Celula poate fi plana sau cilindrica (capilara).
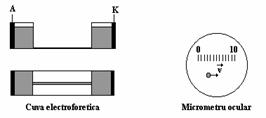
Figura 4.4. Electroforeza microscopica: cuva electroforetica folosita si imaginea
observata la microscop prevazut cu micrometru ocular.
Electroforeza la joasa tensiune - Este o metoda ce permite separarea proteinelor plasmatice. Dispozitivul experimental folosit este prezentat in figura 4.5.
Ca suport al electrolitului (al solutiei tampon) se foloseste atat hartie speciala pentru electroforeza (de tip Whatman) cat si membrane de celuloza. Dintre avantajele utilizarii membranelor de celuloza amintim, in primul rand: rezolutia mult mai buna si un timp de migrare mai mic.
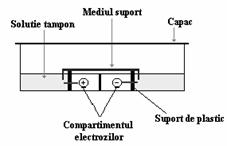
Figura 4.5. Electroforeza la joasa tensiune - dispozitiv experimental.
Dupa separarea proteinelor urmeaza un procedeu de fixare si colorare. In primul rand, mediul suport este fixat prin introducere in etanol, metanol sau acid, ori prin incalzire facand astfel proteinele insolubile.
Benzile sunt colorate cu ajutorul unor coloranti specifici proteinelor (albastru de brom fenol), se spala in mai multe bai cu acid acetic 2% si sunt trecute prin vapori de amoniac pentru regenerarea colorantului (figura 4.6).

Figura 4.6. Electroforeza - mediul suport dupa procedeele de fixare si colorare.
Dupa aceste procedee benzile sunt scanate cu ajutorul unor densitometre prin reflexie, transmisie sau combinate, ce permit trasarea spectrelor caracteristice probelor oferind totodata cantitatea in g/100ml.
Electroforeza pe un mediu suport acetat de celuloza a serului uman este prezentata in figura 4.7.
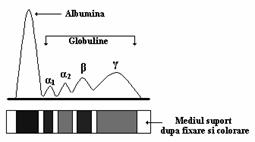
Figura 4.7. Electroforeza pe un mediu suport acetat de celuloza a serului uman.
Este cunoscut faptul ca scaderea albuminelor survine de regula in toate disproteinemiile, fiind insa mai accentuata in cazul unui deficit in aportul de proteine, in deficitul de sinteza (ciroza hepatica), sau in pierderi de proteine (sindrom nefrotic, arsuri).
Cresterea α1, α2 - globulinelor se insoteste de regula de o crestere a fibrinogenului si a glicoproteinelor si de o accelerare a VSH-ului. O crestere marcata a α2 - globulinelor se intalneste in sindromul nefrotic.
Modificarile β - globulinelor au o importanta mai redusa, dar cresterea γ - globulinelor indica prezenta unor inflamatii cronice, sau sugereaza o proliferare reactiva sau tumorala a imunocitelor producatoare de imunoglobuline. Scaderea γ - globulinelor survine in sindromul nefrotic, malnutritie.
Toate aceste modificari au ca rezultat forme diferite ale spectrlor electroforegramelor analizate (figura 4.8).
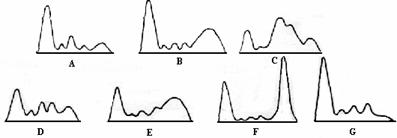
Figura 4.8. Tipuri de disproteinemie: (A) Inflamatie acuta, (B) Inflamatie cronica, (C) Sindrom nefrotic, (D) Enteropatie exudativa, (E) Ciroza hepatica, (F) Mielom multiplu, (G) Hipogamaglobulinemie.
Focalizarea izoelectrica (electrofocusing) - reprezinta o metoda de separare a particulelor cu puncte izoelectrice diferite intr-un gradient de pH sub actiunea unui camp electric omogen.
Punctul izoelectric al unei particule (sau molecule) corespunde valorii pH-ului la care sarcina electrica neta este nula.
Dispozitivele de electrofocusing folosesc o coloana in care se realizeaza un gradient natural de pH prin utilizarea unor amfoliti transportori cu urmatoarele proprietati: buna capacitate de tamponare si buna conductivitate la punctul izoelectric, masa moleculara mica, solubilitate buna la punctul izoelectric, absorbtie mica a luminii peste 260nm, nu reactioneaza chimic cu componentii amestecului ce urmeaza a fi descompus.
Cei mai utilizati sunt acizii poliaminopolicarboxilici avand masa moleculara intre 300-1000D si puncte izoelectrice situate in domeniul de pH=3-10.
II. Parte experimentala
A. Separarea clorofilelor prin cromatografie pe hartie
Materiale necesare: hartie de cromatografie, vas de croma-tografie, micropipete, benzen, eter etilic, ciclohexan, alcooletilic 98%, apa distilata, stativ, mojar.
Mod de lucru: Se mojareaza cateva frunze intr-o solutie de 80% alcool etilic si 20% apa dupa care se lasa intr-un loc intunecat 30 min. Se traseaza foarte fin cu creionul linia de start pe hartie si cu ajutorul unei micropipete se pun spoturile de substanta (o cantitate de 0.1-1ml avand grija ca aceasta sa nu se intinda).
Se pregateste intr-un pahar Berzelius eluentul format din 50% eter etilic, 40% ciclohexan, 8% benzen si 2% apa, se agita bine si apoi se toarna in vasul de cromatografie astfel incat sa acopere fundul vasului cu cel mult 2-3mm.
Se introduce hartia de cromatografie fixata in stativ 1mm in lichid. Se acopera vasul si se asteapta 45min dupa care se trece la identificarea componentelor si la calculul timpilor de retinere pentru fiecare component.
B. Determinarea vitezei electroforetice a eritrocitelor
Materiale necesare: cuva de electroforeza, microscop Biorom, suspensie de eritrocite, sursa de tensiune, solutie izotonica, micrometru ocular, cronometru.
Mod de lucru: Se conecteaza cuva de electroforeza la microscop si se umple cu solutie izotonica dupa care se asteapta 1-5min pana eritrocitele difuzeaza in toata cuva. Se pune la punct imaginea astfel incat sa se observe cu micrometrul ocular o hematie. Se conecteaza sursa de tensiune si se masoara timpul (t) in care o celula se deplaseaza intre doua repere ale micrometrului ocular (d). Datele se trec in tabelul de mai jos.
|
No. |
t(s) |
v (mm/s) |
vmed(mm/s) |
sn-1 |
|
1 |
|
|
|
|
|
|
|
|
|
|

Figura 4.9. Imaginea observata prin micrometrul ocular
(dupa aplicarea campului electric hematiile se afla in miscare cu viteza v)
Deoarece distanta (d) vazuta pe micrometrul ocular si parcursa de celulele in miscare este in diviziuni, trebuie ca aceasta sa fie transformata in microni (mm) pentru a putea fi calculata valoarea vitezei de deplasare.
![]() mm
mm
![]()
![]()
Sa se calculeze intervalul de confidenta si sa se compare valorile obtinute cu cele din literatura.
![]()
![]()
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








