| Aeronautica | Comunicatii | Drept | Informatica | Nutritie | Sociologie |
| Tehnica mecanica |
Tehnica mecanica
|
|
Qdidactic » stiinta & tehnica » tehnica mecanica Obtinerea straturilor metalice prin electrocristalizare |
Obtinerea straturilor metalice prin electrocristalizare
OBTINEREA STRATURILOR METALICE PRIN ELECTROCRISTALIZARE
principiul
Se obtin prin electroliza unei solutii apoase care contine ionii metalului ce se depune.
Electroliza reprezinta un proces fizico-chimic complex provocat de cimpul electric dintre doi electrozi introdusi in solutia sau topitura unui electrolit si legati la bornele unei surse de curent continuu.
Instalatia de electroliza
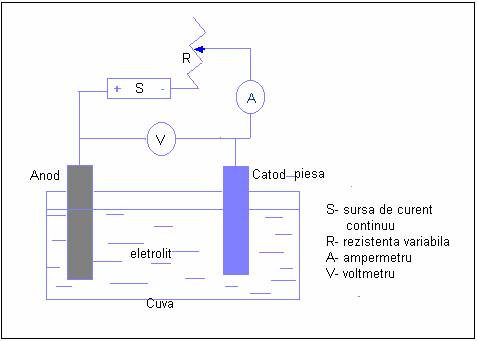
o celula de elctroliza (Cuva) confectinata dintr-un material adecvat agresivitatii solutiei de electrolit
o solutia de electrolit
o electrozii (aodul si catodul),
o circuitul electric format din conductori electrici, rezistenta variabila (R), sura de curent continuu (S) si instrumente de masura (ampermetru A, voltmetru V).
La baza oricarei electrolize se afla un proces de oxido-reducere, dar
electroliza incepe cu inchidrea circuitului,
continua cu orientarea ionilor in cimpul electric
deplasarea acestora catre electozii de semn contrar
apoi cu procesele electrochimice de la electrozi.
o anodul este electrodul la care are loc reactia de oxidare-la electroliza se vor oxida ionii negativi numiti anioni si de aceea acest electrod este polarizat pozitiv-
o catodul este electrodul la care are loc reactia de reducere a cationilor si va fi deci este polarizat negativ.
Procesele de electrod la electroliza sunt in principiu urmatoarele:
(-) ionii pozitivi se indreapta catre polul negativ al celulei unde primesc electronii necesari si se reduc.
Mz++ ze- M
(+) ionii negativi se indreapta catre polul pozitiv care are un deficit de electroni; aici are loc o reactie de oxidare.
A-n A + ne-
Simultan cu aceste reactii principale, au loc si o serie de reactii secundare, ca rezultat al diferitelor reactii care au loc in jurul electrozilor intre produsele de electroliza, intre acestea si electrozi, intre produse si electrolit.
Electroliza are loc atunci cind intre electrozi se aplica o diferenta de potential numita tensiune de descompunere. Tensiunea de descompunere este tensiunea minima necesara pentru a se produce electroliza.
Relatii cantitative in electroliza .Legile electrolizei
a).Prima lege alui Faraday
Cantitatile de substante transformate la electrozi in timpul electrolizei sunt proportionale cu cantitatea de electricitate trecuta prin electrolit.
m = k I t = k Q
unde : *m - masa de substanta transformata la electrozi , grame;
*I - intensitatea curentului de electroliza , A;
*t -. timpul de electroliza in secunde, s;
*k - constanta de proportionalitate;
*Q - cantitate de electricitate, C.
b) Adoua lege a lui Faraday
Masele diferitelor substante separate la electrozi de aceeasi cantitate de electricitate, sunt proportionale cu echivalentii lor chimici, pentru depunerea unui echivalent gram de substanta fiind nevoie de o cantitate de electricitate de 96 496 coulombi, C.
Aceasta cantitate de electricitate este denumita constanta sau numarul lui Faraday F.
Stiind ca:
1 coulomb = 1 amper. secunda
rezulta ca
1F = 96496 amperi x secunda = 26,8 amper x ora
Deoarece 96496 C separa la electrozi un echivalent gram de substanta, atunci un coulomb va separa "k" grame de substanta:

in care:E este echivalentul gram al substantei separate, grame;
A - masa atomica a substantei separatte, g;
n - numarul de electroni implicati in reactia de electrod;
k reprezinta cantitatea de substanta in grame, separata de un coulomb de electricitate; se numeste echivalent electrochimic .
Cumuland cele doua relatii
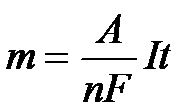
|
c) Randamentul de curent
Datorita proceselor secundare de la electrozi, sau diferitelor rezistente ce pot aparea in circuitele de electroliza, cantitatea de substanta separata practic este intotdeauna mai mica decit cea calculata.
Randamentul de curent se calculeaza cu relatia:
 (5.40)
(5.40)
unde: *mp este masa practic depusa
*mt este masa teoretic depusa, calculata cu legea lui Faraday pentru acelasi consum de electricitate
Obtinerea straturilor metalice
(-)CATODUL este suportul pe care se depune stratul (piesa care se protejaza), pe suprafata sa are loc reducerea catodica a ionilor metalici:
Me+2 + 2e-= Me(1)
(+) ANODUL este confectionat din acelasi material cu stratul, este sursa de ioni
Me = Me+2 + 2e-(2)
Viteza de depunere este proportionala, conform legilor lui Faraday, cu cantitatea de electricitate ce trece prin electrolit, adica cu intensitatea curentului electric si timpul de electroliza.
m=K I t (3)
in care K este echivalentul electrochimic al metalului care se depune
![]() (4)
(4)
unde E este echivalentul chimic al metalului, A masa atomica iar z numarul electronilor implicati in procesul de electrod.
Randamentul de curent al procesului de electrodepunere se poate calcula in mai multe moduri:
a)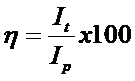 (5)
(5)
in care It reprezinta intensitatea teoretica a curentului necesare pentru depunerea unei grosimi date a stratului sau a unei cantitati de metal "m"; Ip reprezinta intensitatea practic utilizata pentru depunerea cantitatii de metal "m" in acelasi timp de electroliza;
b)
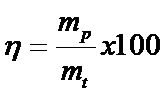 (6)
(6)
1.3 Proprietatile stratului depus
1) Structura- poate fi fina sau grosiera in functie de raportul dintre viteza de nucleere si cea de crestere a germenilor. Astfel, daca viteza de nucleere este mare numarul germenilor este mare si deci structura va fi fina. Din contra, daca viteza de nucleere este mica si cea de crestere mare apar graunti mari si structura este grosiera. Din punct de vedere al proprietatilor mecanice este de dorit o structura fina.
2) Textura. Din punct de vedere al orientarii grauntilor exista trei tipuri de texturi:
a) cristalele se depun total dezordonat pe suprafata suportului, depozitul este total netexturat , foarte aproape de izotropia proprietatilor;
b) cristalele se depun cu o fata paralela cu suprafata suportului iar celelalte fete dezordonat; este o textura incompleta;
c) cristalele se depun ordonat Viteza cea mai mare de crestere este cea perpendiculara pe suprafata suportului si minima cea paralela cu aceasta.
3) Proprietati mecanice Cele mai importante proprietati mecanice sunt tensiunile interne, duritatea si fragilizarea
a) Tensiunile interne sunt de doua feluri: tensiuni de contactie si de dilatare. Marea majoritate a metalelor depuse catodic formeaza depozite cu tensiuni interne de contractie. Astfel, in depozitul de crom iau nastere tensiuni interne de ordinul 5000 Kgfcm-2 iar in depozitul de nichel de ordinul 3000 Kgfcm-2. Singurele metale care depun straturi catodice cu tensiuni interne de dilatare sunt Zn, Cd, si Pb.
Sursele tensiunilor interne sunt diferentele intre parametrii de reta a metalului suport si depus, variatia distantei intre cristalite, comasarea cristalelor, formarea compusilor chimici faze noi, includerea atomilor straini sau a substantelor tensioactive.
b) Duritatea depozitului este puternic influentata de structura acestuia, astfel, o structura fina se caracterizeaza prin duritate mare.
c) Fragilitatea este direct proportionala cu nivelul tensiunilor interne. Un nivel ridicat al acestora fragilizeaza depozitul.
d) Luciul depozitului - alta proprietate mecanica si optica.
Proprietatile bailor de depunere
Puterea de patrundere sau capacitatea de dispersie a liniilor de curent
Teoria puterii de patrundere
Prin putere de patrundere se intelege proprietatea solutiei de electroliti de a realiza depuneri de grosime egala pe toata suprafata catodului.
De regula depunerile sunt neuniforme din punct de vedere al grosimii datorita repartizarii neuniforme a densitatii de curent.
Fie doi catozi aflati la distante diferite de anod (fig. 1) a = apropiat cu rezistenta Ra si d =departat cu rezistenta Rd.
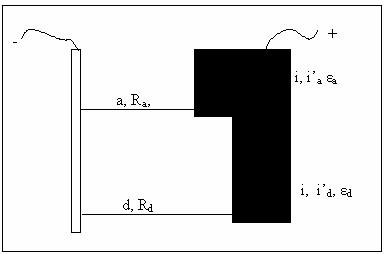
Figura 4
In lipsa polarizatiei, densitatile de curent pe cele doua zone ale catodului, densitatile de curent sunt ia, respectiv id care sunt proportioale cu 1/a respectiv 1/d., deci i1, > i2 .
Se defineste repartizarea primara a curentului determinata de factori geometrici, adica de marimea, forma si pozitia relativa a electrozilor,
![]() . (4)
. (4)
In sistemele reale insa exista intotdeauna fenomenul de polarizare datorita caruia potentialele anodului si catodului sunt diferite de valorile lor de echilibru.
Astfel, daca in prezenta polarizarii potentialul catodului in zona apropiata este ε'a, atunci densitatea de curent reala va fi i'a, respectiv pentru zona departata vom avea, ε'd, respectiv i'd. In aceste conditii repartizarea reala secundara a liniilor de curent pe suprafata catodului va fi exprimata prin raportul
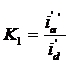 (5)
(5)
Repartizarea secundara a liniilor de curent depinde prin urmare de factorii fizici si electrochimici care influenteaza polarizarea catodica, adica de valoarea curentului, temperatura, de agitarea electrolitului, de compozitia electrolitului
Daca se tine seama si de randamentul de curent atunci repartizarea secundara poate fi exprimata prin relatia (6)
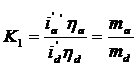 (6)
(6)
in care, conform legii lui faraday, raportul![]() este egal cu raportul maselor de metal care se depun pe cele
doua zone deoarece echivalentii electrochimici 1 si 2 sunt aceeiasi, se depune
acelasi metal si timpul de electroliza este acelasi.
este egal cu raportul maselor de metal care se depun pe cele
doua zone deoarece echivalentii electrochimici 1 si 2 sunt aceeiasi, se depune
acelasi metal si timpul de electroliza este acelasi.
Se defineste Puterea de patrundere P, raportul
![]() (7)
(7)
sau
![]() (8)
(8)
Asa cum este definita puterea de patrundere se observa ca si atunci cind K2 =1 deci depunerea este uniforma, P≠1, de exemplu pentru K=2 si K2=1, P=50%. In literatura de specialitate exsita mai multe tipuri de relatii empirice care incearca sa defineasca aceasta caractersitica a bailor de depunere.
Factori ce influenteaza puterea de patrundere
A) Factori geometrici
a) Forma cuvei de electroliza. Cuva poate avea forma cilindrica sau paralelipipedica.
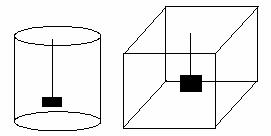
Figura 5
Din distributia liniilor se observa ca cea mai uniforma este in cuva paralelilipipedica.
B) Poztia electrozilor in cuva si marimea acestor, respectiv distanta dintre anozi si catozi.. Exista in aces caz urmatoarele situatii limita:
Distanta dintre fundul cuvei si catozi este mare, grosimea stratului va fi mai mare in partea inferioara
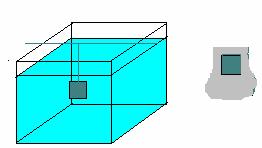
Figura 6 a)
C) Distanta dintre suprafata libera a electrolitului si catozi este mai mare, grosimea stratului va fi mai mare in partea superioara
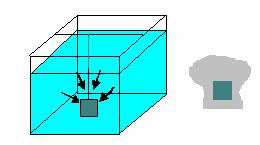
figura 6 b)
D) Catodul este pozitionat la egala distanta de peretii cuvei si de anozi, grosimea stratului electrodepus este uniforma pe toate fetele catodului

Factori electrochimici:
E) Polarizarea (supratensiunea) catodica ηc
Influenta polarizarii catodice se pune in evidenta cu ajutorul celulei Hull, o cuva cu dimensiuni si forma standardizate in care distanta dintre anod si catod este variabila. Celula Hull are vederea de sus sub forma unui trapez dreptunghic, anodul este fixat pe inaltimea trapezului iar catodul pe latura oblica..
Fie doua puncte pe suprafata catodului caracterizate de potentialele ε1 si ε2 , cu densitatile de curent i1 si i2 respectiv distanta anod-catod l2 si l2 . Polarizarea anodului este uniforma pe toata suprafata deci potentialul anodic este εa.
Bilantul energetic pe cuva este exprimat de ecuatia (9):

Figura 7 Celula Hull
εc1 + ρi1l1 +εa = εc2 +ρl2i2 + εa (9)
rezistivitatea ρ a electrolitului este aceasi in orice punct.
εc1 -εc2= ρ (i2l2 -i1lI )(10)
(i2l2 -i1lI
) = ![]() =
=![]() (11)
(11)
in care σ reprezinta conductivitatea electrica a solutiei.
Prin urmare, distributia liniilor de curent va fi cu atit mai uniforma cu cit rezistivitatea specifica a electrolitului va fi mai mica, cu cit variatia polarizarii fata de densitatea de curent va fi mai mare si cu cit distanta anod-catod este mai mare.
O alta modalitate de imbunatatite a puterii de patrunsdere consta in utilizarea anozilor profilati care sa urmareasca forma catodului.
Capacitatea nivelanta a electrolitilor
Asa cum se cunoaste suprafata reala a unui solid policristalin obtinuta prin procedee mecanice sau metalurgice nu este perfect plana, ea prezinta o anumita rugozitate, caracterizata de existenta unor microproeminenete si a unor microadincituri. Acest profil al suprafetei are un efect de imprastiere a liniilor de curent care se concentreaza pe microproeminenete ceea ce duce la acentuarea rugozitatii naturale a suportului metalic. Dar unul dintre obiectivele protectiei suprafetelor consta in realizarea unui aspect decorativ prin atenuarea defectelor de suprafata. Acest obiectiv se realizeaza prin microredistribuirea liniilor de curent proprietate numita capacitatea de nivelare a electrolitilor de electrodepunere.
PRINCIPIAL
La polul negativ se prinde piesa care se acopera
o In solutie se gasesc ionii metalului de acoperire sub forma de ioni pozitivi
o Ionii pozitivi se deplaseaza catre polul negativ , piesa
o Ionii pozitivi primesc electroni de la catod
M+n + ne = M
Se transforma in atomi care cristalizeaza pe suprafata
La polul pozitiv se prinde anodul confectionat din metalul care se depune, si care se transforma in ioni , mentinind compozitia acestora constanta
o M=M+n +ne
Zincare
Catodul=piesa de acoperit
Solutuie+electrolitul contine oni de zinc ZnO, NaCN, NaOH, Zn(CN)2
Anod zinc metalic
Rreactiile de depunere
Catod Zn+2 + 2e=Zn
Anod Zn =Zn+2 +2e
Cuprare
Catodul =piesa
Electrolitul CuSO4, H2SO4 ,
ANODUL=cupru
Catod Cu+2 +2e= Cu
Anoid Cu=Cu+2 +2e
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||