
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Nefropatia tubulointerstitiala urica - acuta si cronica - fiziopatologie |
Nefropatia tubulointerstitiala urica - acuta si cronica - fiziopatologie
Nefropatia tubulointerstitiala urica - acuta si cronica - Fiziopatologie
A. Metabolismul purinelor
Cei trei compusi prin care se realizeaza excretia azotului sunt: uree, acid uric si amoniac. Acidul uric este produsul final de catabolism al purinelor endo- si exogene. In plasma, la pH = 7.4, numai una din cele 3 grupari hidroxil disociaza intr-o proportie semnificativa (pk = 5.44), asa ca in vivo acidul uric este de fapt un acid organic monovalent (urat monosodic). In urina, unde pH-ul scade, are loc o transformare inversa, predominand acidul uric. Formula sa chimica este 2,6,8 trioxipurina.
Acidul uric este eliminat din organismul uman: ca atare, predominant prin excretie urinara (excretia urinara de acid uric este foarte eficienta, deoarece uratul nu se leaga de albumine si trece usor prin podocite), la care se adauga si o excretie pe cale digestiva - prin secretii gastrice, biliare, intestinale - si care creste atunci cand exista un oarecare crad de insuficienta renala.
La alte mamifere, precum si la nivelul bacteriilor care populeaza colonul, exista o enzima - uricaza - ce are ca rol desfacerea inelului puric, rezultand astfel alantoina si CO2. In conditii de insuficienta renala, uricoliza intestinala va ajunge la 80% ca pondere a caii de degradare si eliminare a acidului uric (in mod normal ea nu reprezinta mai mult de 20%).
a) Biochimia bazelor purinice.
Acizii nucleici (AND si ARN) contin in molecula acid fosforic, glucid si o baza purinica, respectiv pirimidinica.
Bazele purinice sunt alcatuite dintr-un inel pirimidinic cu 6 atomi si unul imidazolic cu 5 atomi. Originea fiecaruia dintre atomii componenti ai purinelor ai purinelor, se poate observa in figura de mai jos:
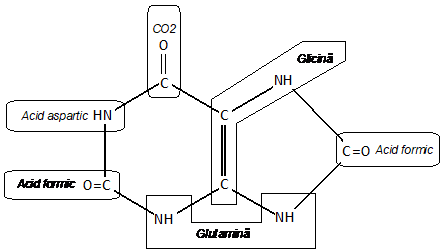
Cele mai importante baze purinice sunt adenina, guanina, hipoxantina, xantina si acidul uric. Ele prezinta toate izomeriile de tip lactom-lactim.
Nucleotidele purinice sunt alcatuite dintr-o baza purinica plus o pentoza, legata de prima printr-o legatura azot glicozidica (N-glicoza) formata intre carbonul 1 al pentozei si azotul 9 al bazei purinice.
Nucleozidele purinice sunt constituite dintr-un nucleotid purinic, la care este adaugata o grupare fosfat legata de primul printr-o legatura esterica cu carbonul 5 al pentozei.
Nucleozidele si deoxinucleozidele pot exista atat sub forma de 5-monofosfa, cat si ca 5-difosfat si 5-trifosfat.
Acesti compusi au rol atat in formarea acizilor nucleici (ADN si ARN), cat si ca precursori ai diverselor nucleotide, precum si ca sursa de energie pentru diverse reactii biochimice din organism (ATP, ADP si cAMP) si de asemenea sunt precursori pentru diferiti cofactori purinici si coenzime ca NAD(P) (nicotinamid-adenin-dinucleotid) si FAD (flavin-adenin-dinucleotid).
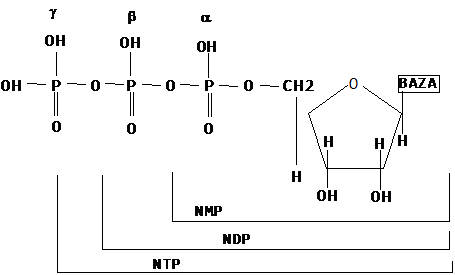
Structura nucleozidelor sideoxinucleozidelor
b) Biosinteza purinelor
Biosinteza bazelor purinice se poate efectua in organism prin doua cai: calea "consumatoare de energie" (se folosesc 5 moli de ATP pentru sinteza unui mol de purina) si calea "de salvare", care necesita un singur mol de ATP pentru sinteza unui mol de purina. Purinele exogene, care provin din dieta, nu sunt incorporate in nucleotide intracelulare, ci sunt rapid degradate pana la acid uric.
Biosinteza purinica de nuovo:
Un compus chimic in cadrul reactiilor acestei cai este reprezentat de catre 5-fosforibozil-1-pirofosfat (PRPP), el fiind sintetizat din riboza 5-fosfat si ATP sub actiunea PRPP-sintetazei.
Primul pas specific in biosinteza purinica si care reprezinta in acelasi timp reactia limitanta de viteza a intregii cai este constituita din conversia PRPP in 5-fosforibozilamina, sub actiunea amido-fosforibozil transferazei (APRT) sau PRPP-amidotransferazei. In cadrul acestei reactii gruparea pirofosfat este inlocuita de gruparea amidica provenita din glutamina.
Factorii care influenteaza activitatea enzimei APRT sunt reprezentati pe de o parte de disponibilul de substrat (disponibilul de PRPP) si pe de alta parte activitatea sa este reglata printr-un mecanism de feed-back realizat de catre produsii finali ai metabolismului purinic, si anume AMP si GMP, care in cantitati crescute inhiba actiunea PRPP-amidotransferazei, cat si pe cea a PRPP-sintetazei.
In conditii normale scadera nivelului PRPP - in vivo/in vitro duce la o scadere a ratei biosintezei purinice de novo, iar o crestere a nivelului sau duce la o crestere a biosintezei purinice. Trebuie mentionat insa ca un nivel al PRPP initial crescut apoi revenit la normal nu are efect inhibitor (nu influenteaza) asupra sintezei purinice de novo.
Cea mai importanta cale de reglare a acestei cai este totusi reprezentata de catre activitatea enzimei PRPP-amidotransferazei. Aceasta enzima exista in 2 forme moleculare - una cu greutate moleculara mica (133 000 daltoni), iar alta cu greutate moleculara mare (270 000 daltoni), cea din urma fiind o forma inactiva. In prezenta AMP si GMP, PRPP-amidotransferaza trece din forma activa in forma inactiva cu grutate moleculara mare, iar prezenta PRPP duce la inversia PRPP-amidotransferazei din forma inactiva in forma activa cu greutate moleculara mica.
Acidul inozinic este primul nucleotid purinic complet format de novo pe o cale alcatuita din 5 reactii, formarea sa reprezentand un punct
de rascruce de la care se poate porni fie spre formarea de AMP, fie catre formarea de GMP. Se pare ca formarea acidului inozinic de una sau de cealalta dintre aceste cai este influentata de concentratia intracelulara de guanozin trifosfat (GTP), care reprezinta un substrat pentru adenilsuccinatsintetaza si de asemenea este un inhibitor al dehidrogenazei acidului inozinic. Astfel, odata format, acidul inozinic este folosit pentru sinteza XMP, acid guanilic (GMP), GDP, GTP. In momentul in care concentratia GTP atinge o concentratie critica, la nivel celular are loc o crestere a activitatii AMP-sintetazei, ceea ce duce la utilizarea acidului inozinic catre formarea de AMP, de data aceasta. Un nivel inalt al GTP intracelular duce nu numai la stimularea AMP-sintetazei, dar si la inhibarea transformarii acidului inozinis in XMP (precursorul formarii GMP). In conditiile in care are loc o supraproductie de purine sintetizate de novo, are loc si o supraproductie de acid inozinic si are loc o degradare rapida a ribonucleozidelor in exces in acid uric. Controlul ce are loc in aceste circumstante si care duce la o crestere a eliminarii de acid uric este determinat de competinta intre 5'-nucleotidaza si acidul inozinic.
AMP, IMP si GMP pot fi de asemena descompusi de catre 5'-nucleotidazele specifice sau de catre fosfataza in ribonucleozide ce sunt mai departe reutilizate sau catabolizate. Scaderea rapida a concentratiei ATP in urma utilizarii sale duce la o crestere consecutiva si rapida a nivelurilor de AMP si IMP. In majoritatea tesuturilor cu exceptia probabil a inimii, degragarea AMP survine in mod normal in urma dezaminarii, cu formarea IMP. In mod diferit, dAMP provenit din turn-over - ul acizilor nucleici nu constituie un substrat pentru AMP-dezaminaza si trebuie convertita la deoziadenozina.
Reglarea degradarii nucleotidelor trebuie controlata in organism de catre cele doua enzime: AMP-dezaminaza si 5-nucleotidaza.
AMP dezaminaza este activata de catre AMP si ATP si este inhibata de GTP si fosfat anorganic (Pi). Urmarea scaderii inhibitiei asupra AMP-dezaminazei o constituie cresterea productiei de acid uric.
Proprietatiile catalitice si regulatorii ale acestor doua enzime arata ca ambele nucleotide, atat ADP, cat mai ales ATP, ca si Pi au activitate modulatorie asupra catabolismului nucleotidelor. Astfel, nivelurile de ADP si ATP intracelular au activitate stimulatoare asupra AMP-dezaminazei si nucleozidazei cu Km inalt, in timp ce inhiba nucleotidaza cu Km scazut. Tot nivelul acestor nucleotide influenteaza de asemenea si rata formarii AMP prin influenta exercitata asupra adenilat-kinazei, ce catalizeaza transformarea reversibila a ATP si AMP in ADP. Sensul acestei reactii, cat si intensitatea ei sunt influentate de concentratiile relative ale AMP, ADP si ATP. GTP activeaza nucleotidaza cu Km inalt si inhiba AMP-dezaminaza si nucleotidaza cu Km scazut.
Fosfatul anorganic (macroergic) are, de asemenea, o mare importanta in reglare. El inhiba AMP-dezaminaza, 5-nucleotidazele si fosfatazele nespecifice. De asemenea, s-a constatat ca concentratiile inalte de acid inozinic satureaza sintetaza acidului adenilsuccinic si dehidrogenaza acidului inozinic, apoi duce la o activare a 5-nucleotidazei, ceea ce determina transformarea acidului inozinic in enzima care sub actiunea unei fosforilaze formeaza lipoxantina, apoi sub actiunea xantin-oxidazei duce la xantina si acid uric.
GMP si AMP sunt oarecum "protejate" de a urma aceasta suita de reactii prin faptul ca datorita existentei lor predominante sub forma de trifosfati (GTP si ATP), nu constituie un substrat preferential pentru actiunea 5-nucleotidazei.
In continuare guanozina si deoxianalogii ei sunt transformati sub actiunea purin-nucleotid-fosforilazelor (PNP) in hipoxantina si guanina. Adenozina si deoxiadenozina nu sunt substraturi pentru actiunea PNP in celulele mamiferelor, iar degradarea lor are loc doar in urma dezaminarii lor pana la inozina/deoxiinozina sub actiunea adenozin-dezaminazei (ADA).
Astfel, singurele purine libere formate din nucleotidele purinice prin degradarea acestora sunt hipoxantina si guanina.
In mod normal majoritatea cantitatii de hipoxantina si guanina formata pana in acest punct, intra in biosinteza bazelor purinice prin reconversie si cuplare cu PRPP cu utilizarea unui singur mol de ATP, sub actiunea unei enzime comune numita hipoxantin-guanin-fosforibozil-transferaza (HGPRT), ce este la randul ei inhibata de produsii finali AMP si GMP. Aceasta cale de reconversie este o cale "de salvare", rezultand astfel pierderi minime de purine endogene si este, din punct de vedere energetic, mult mai putin costisitoare decat calea biosintezei de novo; de altfel, AMP si GMP rezultate pe aceasta cale au efect inhibitor si asupra caii sintezei de novo.
Datorita faptului ca la pacientii cu deficit total/partial de HGPRT s-a constatat existenta unei rate crescute a formarii purinelor si de asemenea o rata crescuta a hiperuricemiei, s-a tras concluzia ca aceasta enzima are un rol esential in reglarea metabolismului purinic. Incapacitatea de a "recicla" hipoxantina si guanina duce la inlaturarea feed-back-ului GMP-ului si AMP-ului. De asemenea, la pacientii cu deficit al enzimei purin-nucleotid-fosforilaza (PNP) are loc o acumulare a precursorilor inozina si guanozina concomitent cu un deficit de utilizare a caii de reconversie, inozina si guanozina neputand fi transformate in bazele lor corespondente spre a oferi substratul necesar HGPRT. Consecutiv, la pacientii cu deficit total de PNP se manifesta un deficit de HGPRT si s-a demonstrat existenta unui nivel crescut intracelular al PRPP, asociat cu o supraproductie purinica de novo, ceea ce duce la o simptomatologie clinica derivata din existenta ambelor defecte (de PNP si HGPRT) si anume retard neurologic si neurodeficienta congenitala grava, precum si alterari ale liniei limfocitelor T.
c) Formarea acidului uric
Bazele purinice generate in urma metabolizarii purinelor sunt, in principal, guanina si hipoxantina.
Guanina este convertita la xantina sub actiunea unei guanaze, iar hipoxantina este transformata in xantina sub actiunea xantin-oxidazei, xantina fiind mai departe oxidata la acid uric de catre aceeasi enzima.
Se poate observa ca xantina are trei precursori potentiali; xantozina, hipoxantina si guanina.
Xantin-oxidaza este o flavoproteina ce contine fier si molibden si care are o actiune oxidativa asupra mai multor purine. Ea se prezinta in organism sub mai multe forme:
- o forma solubila cu activitate de dehidrogenaza (xantin-dehidrogenaza formei D);
o forma cu activitate de oxidare (xantin-oxidaza).
Forma D este convertita in xantin-oxidaza prin oxidarea unei grupari tiolice in special in prezenta unei concentratii crescute de oxigen. Responsabila pentru formarea acidului uric ca si produs final al metabolismului purinic la om este forma D a xantin-oxidazei, ea transformand atat hipoxantina in xantina, cat si pe aceasta din urma in acid uric, concomitent fiind generate anionul superoxid si peroxidul de hidrogen.
hipoxantina + H2O + 2O2 → xantina + 2O2- + 2H+
sau
hipoxantina + H2O + O2 → xantina + H2O2
xantina + H2O + 2O2 → acid uric + 2O2- + 2H+
sau
xantina + H2O + O2 → acid uric + H2O2
Peroxidul de hidrogen poate fi convertit in radicali liberi de hidrogen, astfel:
Fe2+ + H2O2 → Fe3+ + OH- + OH+,
acesta impreuna cu O2-, H2O2 si OH-, avand un rol foarte important in reactiile inflamatorii si distrugerea tisulara. Astfel, se pare ca xantin-oxidaza are un rol foarte important in starile de ischemie tisulara in care are loc o distrugere masiva de nucleotide.
De asemeni, xantin-oxidaza are o activitate importanta la nivelul celulelor hepatice si cele ale mucoasei intestinului subtire; in schimb nu este deloc activa la nivelul leucocitelor, eritrocitelor sau fibroblastilor. Enzima a fost izolata si la nivelul celulelor endoteliale, unde s-a crezut ca are un rol in apararea antimicrobiana.
Din cauza distributiei restranse a xantin-oxidazei la nivelul organismului uman, se pare ca si productia acidului uric este un proces predominant hepatic, ce are loc in urma transportului produsilor de degradare a purinelor la nivelul ficatului. Nivelurile plasmatice ale xantinei si hipoxantinei sunt foarte scazute - aproximativ 0.1 - 0.3 mg/dl si de asemenea au fost detectati plasmatic alti precursori ai acidului uric, cu exceptia doar a inozin-5-monofosfatului (IMF), ce apare plasmatic in urma efortului muscular executat in conditii hipoxice.
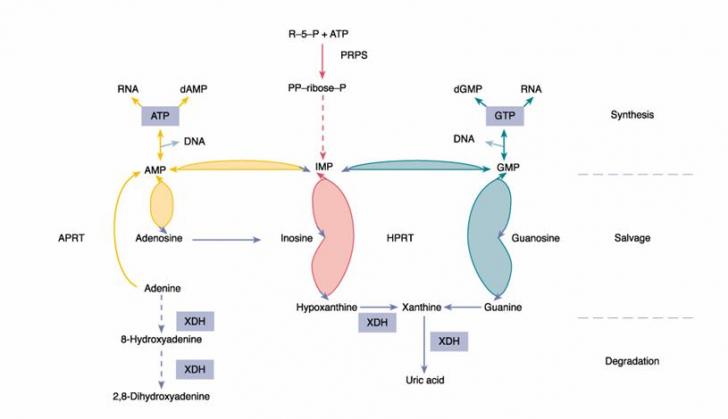
relatiile metabolice intre purine
XDH = xantin dehidrogenaza/oxidaza; HPRT = hipoxantin guanin fosforibozil transferaza; APRT = adenin fosforibozil transferaza; PRPS = fosforibozil pirofosfat sintetaza; MP = monofosfat; TP = trifosfat; A = adenina; G = guanina; R = riboza; P = fosfat.
B. Originea acidului uric
Acidul uric are doua surse de provenienta: exogena si endogena.
Aportul exogen: in mod normal, dieta unui om normal contine cantitati variabile de purina, care contribuie atat la mentinerea unui anumit nivel seric al acidului uric, cat si la eliminarea renala. Aceasta contributie a aportului exogen depinde atat de calitatea purinei ingerate, cat si de cantitatea lor. Diferite studii au aratat ca o dieta lipsita de purine (de exemplu post) duce, in timp de zece zile, la o scadere a nivelului plasmatic al acidului uric de la 4.9 mg/dl la aproximativ 3.1 mg/dl, iar in ceea ce priveste excretia urinara aceasta scade de la 500-600 mg/24h la 336 39 mg/24h.
Se considera astfel ca, aproximativ 50% din purinele derivate din ARN si 25% din purinele derivate din ADN sunt absorbite si apoi secretate urinar sub forma de acid uric. Diferenta intre cantitatea de purine ingerata si cea excretata se pare ca s-ar datora unei hidrolize partiale sau unei inhibitii partiale a biosintezei purinice de novo sau mai degraba unei combinatii intre acesti factori, desi unii autori au sugerat faptul ca sinteza endogena de acid uric nu este inhibata de cresterea aportului purinic prin dieta.
Sinteza endogena: s-a constatat ca o dieta lipsita de purine duce, dupa 5-7 zile, la o scadere a eliminarilor urinare de acid uric, insa apoi urmeaza o crestere de la 336 39 mg/24h la 426 81 mg/24h, aceasta valoare reflectand existenta unei sinteze continue si turn-over-ul purinelor endogene. O abordare mai amanuntita a sintezei endogene a acidului uric a fost facuta in capitolul "Metabolismul purinelor".
C. Excretia acidului uric
Excretia acidului uric se face in principal pe doua cai:
1. calea intestinala (extrarenala) - prin procesul de uricoliza intestinala. Aceasta cale este raspunzatoare pentru 1/3 din cantitatea de acid uric excretata.
2. calea renala - raspunzatoare pentru 2/3 din cantitatea de acid uric excretata.
Excretia intestinala a acidului uric
In absenta unei enzime (uricaza), ce la alte specii are rolul de a transforma acidul uric in alantoina, omul secreta acidul uric ca atare, in afara unei mici cantitati transformate in alti compusi la nivel tisular. Astfel s-a constatat ca leucocitele au capacitatea de a supune acidul uric unei reactii de peroxidare.
Pentru studierea cailor de eliminare a acidului uric s-a administrat o anumita cantitate de acid uric marcat radioactiv, observandu-se ca eliminarea renala nu acopera toata cantitatea administrata; astfel s-au recuperat intre 55 si 95% din 15N apartinand acidului uric marcat. Aceste studii au demonstrat ca exista o cale extrarenala de eliminare a acidului uric, cu un potential de 20-25% si de asemenea ca acesta intra zilnic intr-un proces de turn-over, la persoanele normale acesta cantitate fiind mai mare decat cantitatea excretata urinar, acest surplus fiind estimat la 100-365 mg/zi. (diferenta intre acidul uric ce participa zilnic la procesul de turn-over si cantitatea de acid uric excretata urinar zilnic). Procentul de acid uric ce este eliminat urinar in urma procesului de turn-over s-a constatat ca este egal cu procentul de acid uric eliminat urinar in urma administrarii sale i.v.
Aproximativ 100 mg de acid uric intra in tractul intestinal prin intermediul salivei, sucului gastric si al bilei si o cantitate asemanatoare prin intermediul sucului pancreatic si intestinal. Aceste concentratii sunt suficiente pentru ca degradarea lor sa participe la 1/3 din eliminarile zilnice de acid uric; astfel la nivel intestinal acidul uric este oxidat pana la alantoina, acid alantoic, uree si CO2 de catre uricaza si alte enzime prezente in bacteriile intestinale, aproximativ 200 mg de acid uric fiind excretate zilnic in acest mod, excretia extrarenala putand fi deci considerata sinonima cu uricoliza intestinala.
Excretia renala de acid uric
Desi s-a dovedit ca exista si o cale de excretie digestiva a acidului uric, calea sa predominanta de excretie ramane totusi cea renala; excretia urinara zilnica, in conditiile unei diete fara purine ajungand la 400 mg/zi (2.4 mmoli) si, desi este in mod obisnuit mai mica de 600 mg/zi, ea poate creste in conditiile unei alimentatii bogate in purine si mai ales in conditiile in care functia renala este intacta, ajungand pana la 1000 mg/zi si chiar peste.
Clearence-ul renal mediu pentru urati la persoanele sanatoase este cuprins in mod obisnuit intre 5.8 ml/min si 8.7 ml/min, ceea ce reprezinta mai putin de 1/10 din clearence-ul renal pentru inulina.
Eliminarea renala a acidului uric cuprinde patru etape:
a. filtrarea glomerulara;
b. reabsorbtia primara la nivelul tubului contort proximal;
c. secretie tubulara;
d. reabsorbtie tubulara postsecretorie (TCP, ansa Henle, tub colector).
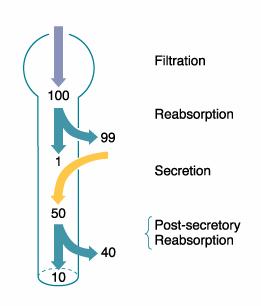
modelul tetracompartimental al eliminarii acidului uric
a. Filtrarea glomerulara
In ciuda controverselor ce exista inca legat de starea uratului in plasma - liber sau legat de proteinele plasmatice , s-a admis totusi ca majoritatea cantitatii de acid uric exista sub forma libera plasmatic si poate participa la procesul de filtrare glomerulara si ca doar o cantitate redusa de acid uric circula legata de proteinele plasmatice (~ 5%). Daca aceasta cantitate este mai mare, asa cum afirma alti autori, acest lucru are ca rezultat o scadere a filtrarii glomerulare a acidului uri; in orice caz, cantitatea de acid uric filtrat glomerular participa in continuare la un proces de resorbtie primara.
b. Reabsorbtia acidului uric
Comparand clearence-ul pentru inulina si cel pentru acid uric, rezulta ca acesta din urma reprezinta doar 0.07 - 0.1 din cel pentru inulina sau creatinina. Admitand ca toata cantitatea filtrata glomerular intra in procesul de reabsorbtie, rezulta ca se absoarbe aproximativ 90 - 93% din uratul filtrat glomerular.
|
Se pare ca procesul de reabsorbtie are loc la nivelul tubului contort proximal. Urina din tubul contort proximal contine totusi o mare cantitate de urat ce va ajunge in urina finala, ceea ce demonstreaza faptul ca are loc un proces de reabsorbtie doar a unui mic procent din uratul secretat sau filtrat la nivelul tubului colector. In concluzie, o mare parte a filtratului glomerular este resorbita la nivelul tubului contort proximal, iar uratul final provine mai ales in urma unei secretii active tubulare. Transportul tubular bidirectional exista la mai multe specii de mamifere, insa anumite detalii privind desfasurarea acestuia sunt inca neclare. Aceste neclaritati privesc locul exact in care au loc aceste transporturile bidirectionale la nivelul nefronului, ce par totusi sa coexiste la nivelul tubului contort proximal, insa s-a demonstrat ca reabsorbtia postsecretorie are loc si la nivelul ansei Henle si a tubului colector.
S-a incercat identificarea precisa a rolului jucat de filtrare, reabsorbtie si secretie prin testul supresiei la pirazinamida, privit astazi cu oarecare suspiciune. Exista dovezi ca reabsorbtia (o parte din ea) are loc la nivelul segmentelor distale - segmente specializate pentru secretie activa, astfel incat o parte din uratul secretat este iarasi reabsorbit. Reabsorbtia uratului este un proces ce are la baza un mecanism de transport activ, mecanism ce are un prag de saturare, ceea ce indica faptul ca probabil este mediat de prezenta anumitor molecule carrier. La soarece s-a constata totusi, ca pe langa procesul de transport activ, are loc si un transport pasiv, in cadrul caruia uratul intra si iese pasiv la nivelul tubului contort proximal prin mecanismul de transport facilitat. La primate si la oameni reabsorbtia are loc activ, impotriva unui gradient de concentratie, diferenta de potential transepitelial la nivelul tubului contort proximal fiind pre mica pentru a permite existenta unui mecanism pasiv.
Diferit studii experimentale au aratat ca exista o serie de legaturi intre reabsorbtia acidului uric si reabsorbtia altor compusi filtrati glomerular ( Na+, glucoza, fosfat, Ca2+, bicarbonat, etc.). Astfel, clearence-ul acidului uric este scazut in toate cazurile in care are loc o cestere a reabsorbtiei proximale de Na+, iar in cazul in care acesta din urma scade, clearence-ul de acid uric creste.
La persoanele cu insuficienta renala cronica, reabsorbtia Na+ la nivelul nefronului este scazuta, iar excretia acidului uric la nivel renal este ridicata, avand astfel loc o crestere a fractiei excretate, desi secretia este mult scazuta.
In bolile renale severe, 45% din uratul filtrat poate scapa mecanismului de reabsorbtie si poate fi excretat. Pentru aceasta se considera ca secretia tubulara este principalul mecanism de excretie a uratului la omul sanatos sau cu o disfunctie renala minora, in timp ce la persoanele cu boli renale avansate, rolul principal in excretia de urat este detinut de catre filtrarea glomerulara.
Tot legat de modificarile ce pot apare la nivelul reabsorbtiei tubulare de Na+, s-a observat ca acest proces sufera schimbari concomitente cu schimbarile survenite la nivelul lichidului extracelular sau ale fractiei filtrate glomerular, schimbari atribuite in fond modificarilor presiunii hidrostatice si a presiunii coloidosmotice la nivelul capilarelor peritubulare. Reabsorbtia tubulara a diferitelor substante ce are loc concomitent cu reabsorbtia Na+ va fi prin urmare afectata de schimbarile de la nivelul acestor factori fizici, astfel incat si reabsorbtia acidului uric va fi influentata de modificarea presiunii hidrostatice si a presiunii coloid-osmotice.
Excretia acidului uric este in mare parte dependenta de pH-ul urinar. PH-ul urinei din tubul contort proximal este aproximativ egal cu cel plasmatic, iar pKa acidului uric este 5.75, ceea ce inseamna ca mai mult de 98% din acesta se afla sub forma ionizata monovalenta la acest nivel. Acidifierea urinei are loc la nivelul tubului contort distal, acest lucru facand ca acidul uric sa fie excretat la nivelul tubului contort proximal.
|
|
Urat seric |
Clearence pt. acid uric |
Lichid extracelular |
Fractia filtrata |
Reabsorbtia Na+ in TCP |
|
Restrictie de Na+ |
↑ |
↓ |
↓ |
↔ |
↑ |
|
Terapie diuretica |
↑ |
↓ |
↓ |
↔ |
↑ |
|
Diabet insipid |
↑ |
↓ |
↓ |
↑ |
↑ |
|
Cresterea angiotensinei (fara cresterea lactatului sau cetoacidoza) |
↔ |
↓ |
↔ |
↑ |
↑ |
|
Cresterea noradrenalinei |
↔ |
↓ |
↔ |
↑ |
↑ |
|
HTA |
↑ |
↓ |
↔ |
↑ |
↑ |
Conditii asociate cu scaderea clearence-ului renal
al aciduluiuric sau cu hiperuricemia
c. Secretia acidului uric
Secretia renala este procesul cel mai important ce contribuie la excretia acidului uric. Existenta unui proces de secretie activa renala a acidului uric se bazeaza pe o serie de date experimentale; astfel, au fost descoperite foarte putine cazuri de hipouricemie asociate unui clearence pentru acid uric mai mare decat cel pentru inulina si in plus, efectul salicilatilor de a micsora excretia de urati la doze mici si de a o creste la doze mari este cel mai bine explicat prin aparitia unei inhibitii la doze mici doar a procesului de secretie, la care se adauga o inhibitie a procesului de reabsorbtie la doze mari. S-a sugerat ca acest efect paradoxal, bifazic al salicilatilor asupra excretiei de acid uric s-ar datora inhibitiei reabsorbtiei de catre salicilat, la care s-ar adauga o inhibitie a secretiei datorata unuia dintre metabolitii sai, si anume saliciluratul.
Sediul la nivelul caruia are loc procesul de scretie nu este bine stabilit. Cele cateva studii care s-au facut la oameni, au aratat ca doar partea proximala a nefronului are rolul de a transfera acidul uric din plasma in interiorul tubilor renali, in timp ce in partea distala a nefronului acest lucru nu este posibil. Aceste experimente duc la concluzia ca la nivelul tubului contort proximal au loc doua procese active de transport, avand sensuri diferite.
Secretia de acid uric este inhibata de o serie de acizi organici slabi, atat la oameni, cat si la mamifere: lactatul, acidul β hidroxibutiric si acidul acetoacetic. Efectul lor se exercita prin inhibitia secretiei tubulare de acid uric si se manifesta printr-o crestere a nivelului seric al uratului in conditii de cetoacidoza diabetica sau de acidoza lactica.
d. Reabsorbtia postsecretorie
S-a constatat ca la pacientii cu boala Hodkin sau maladia Wilson, la care exista hiperuricemie asociata cu un clearence renal crescut pentru urat, pirazinamida are efect de a suprima aceasta uricozurie marcata si de asemenea, s-a observat ca efectul uricozuric al probenecidului este abolit daca se administreaza in prealabil pirazinamida si de asemenea tot in aceasta conditie are loc si o neutralizare a raspunsului uricozuric obtinut in mod normal prin expansiunea lichidului extracelular cu NaCl hiperton sau la administrarea de clorotiazida.
In 1973 Steele si Boner au propus un model ce explica mecanismele reabsorbtiei postsecretorii a acidului uric, model in care efectul pirazinamidei se explica prin aportul scazut de acid uric excretat catre situsurile de reabsorbtie, localizarea acestor situsuri coexistand cu cele pentru secretie.
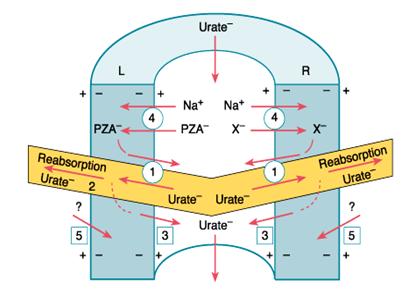
modelul transportului acidului uric in tubul contort proximal
Factori care influenteaza excretia renala a acidului uric
fluxul urinar
Este cert astazi faptul ca atat clearence-ul pentru acid uric, cat si excretia sa renala sunt crescute de cresterea fluxului urinar, dar s-a observat ca exista o limita de 2 ml/min, peste care orice crestere a fluxului urinar nu mai are efect asupra excretiei acidului uric. Astfel, o crestere de la 2.7 la 6.4 ml/min a fluxului urinar antreneaza o crestere a excretiei acidului uric de la 290 la 410 μg/min. Efectele cresterii fluxului sangvin renal (filtrarii renale), sunt dificil de diferentiat de cele obtinute prin administrarea de diuretuce osmotice, dar este in general acceptat faptul ca atat excretia bazala de acid uric, cat si excretia obtinuta prin administrarea de diuretice sunt drastic diminuate prin administrarea prealabila de pirazinamida. S-a sugerat chiar faptul ca uricozuria marcata survenita in urma unei diureze apoase crescute, s-ar datora scaderii procesului de reabsorbtie postsecretorie a uratului din tubul colector.
estrogenii
Estrogenii au ca efect cresterea clearence-ului renal de acid uric. Acest lucru este sustinut de urmatoarele: concentratia uratului seric este scazuta la copii; aceasta creste marcat la persoanele de sex masculin adulte, creste putin la persoanele de sex feminin in perioada fertila, pentru ca sa creasca apoi brusc la menopauza. S-a observat ca media clearence-ului la persoanele de sex feminin era cu 1.2 ml/min mai mare decat la persoanele de sex masculin si ca administrarea exogena de estrogeni duce la o crestere semnificativa a clearence-ului pentru urat de la 6.3 la 9.1 ml/min.
interventiile chirurgicale
S-a observat o crestere a excretiei acidului uric la persoane ce au suferit interventii chirurgicale abdominale, in timp ce nivelul uratului plasmatic nu a prezentat modificari. Concluzia rezultata din aceasta observatie a fost aceea ca are loc o modificare a clearence-ul renal pentru acid uric sub actiunea combinata a anestezicelor, cresterea steroizilor endogeni, cresterea administrarii de lichide pe cale intravenoasa si vagotomiei.
sistemul nervos vegetativ
S-a constatat ca anumiti agenti anticolinergici duc la unii pacienti la o crestere a clearence-ului pentru acid uric, una din explicatiile posibile fiind aceea ca sistemul nervos parasimpatic are un rol in controlul secretiei renale de acid uric, probabil prin influentarea fluxului sangvin peritubular.
D. Proprietatiile fizico-chimice ale acidului uric
1. Ionizarea si formarea de saruri
Acidul uric este un acid slab datorita existentei ionizarii a cate unui atom de hidrogen in pozitia 9 (pka = 5.75) si in pozitia 3 (pka = 10.3). Atomii de hidrogen din pozitiile 1 si 7 nu sunt ionizati. Acidul uric in forma ionizata formeaza saruri mono- sau disodice (sau saruri de urat de potasiu). In lichidul extracelular (sodiul este cationul predominant) aproximativ 98% din acidul uric se gaseste sub forma de urat monosodic la un pH de 7.4. Cand are loc o crestere marcata a concentratiei de acid uric apar cristalele de urat monosodic, care pot precipita la nivel renal si la nivelul sinovialelor articulare, formand tofii gutosi.
2. Solubilitatea in apa
Solubilitatea uratului in apa la 37o C este doar de aproximativ 1mmol/litru la pH = 5, dar creste substantial la 12 mmoli/litru la pH = 8. Solubilitatea acidului uric in apa scade odata cu cresterea ionizarii solutiei, de exemplu in solutiile saline. De acest lucru trebuie tinut cont in cazul urinei, care poate fi concentrata sau diluata, fiind un factor important in formarea cristalelor sau a calculilor de acid uric. De asemenea acidul uric/uratul poate ramane dizolvat in solutii care par a fi suprasaturate, si deci instabile in ceea ce priveste formarea cristalelor si a calculilor. Este important de retinut ca, de asemenea, precursorul metabolic al acidului uric - xantina - este si mai putin solubila (aprox. 1 mmol/l), si ca solubilitatea sa, in comparatie cu cea a uratului/acidului uric, nu creste odata cu cresterea pH-ului, fapt ce are implicatii practice deosebit de importante in tratamentul starilor hiperuricemice, cand exista o supraproductie de urat (supraproductia de urat este insotita de o supraproductie de xantina). Analogul acidului uric - 2,8 dihidroxiadenina - este cel mai insolubil (aprox. 0.03 mmoli/litru la orice valoare a pH-ului). 2,8 dihidroxiadenina se formeaza doar in absenta congenitala a unei enzime (adenin-fosforibozil-transferazei) si este aproape nedetectabila cu metodele uzuale de laborator. Nu numai ca acesti compusi se pot acumula in defectele mostenite ale metabolismului purinelor, dar xantina se poate acumula ca rezultat al inhibitiei xantin-dehidrogenazei de catre Allopurinol si poate fi o cauza nebanuita a insuficientei renale acute in copilarie.
3. Solubilitatea in plasma
Solubilitatea uratului in plasma este mai mare decat in solutiile de Na+, saturatia fiind atinsa la un nivel plasmatic al uratului de 7mg/dl. In solutiile suprasaturate poat fi atinse concentratii mult mai mari. Astfel, la o temperatura de 38o C pot fi obtinute concentratii de aproximativ 400 mg/dl. Aceste solutii sunt insa caracterizate de un inalt grad de instabilitate, uratul monosodic precipitand cu usurinta. La concentratii de 100-200 mg/dl solutia de urat poate ramane stabila mai multe zile, fara sa se produca cristalizarea.
La pacientii cu limfoproliferari maligne, in urma tratamentului citostatic agresiv, urmat de tratament cu Allopurinol, au fost observate niveluri plasmatice de urat de Na+ suprasaturate stabile de 40-90mg/dl. Factorul responsabil de cresterea solubilitatii plasmatice a uratului monosodic la acesti pacienti pare a fi constituit atat de existenta unei tendinte naturale a acestuia de a forma solutii suprasaturate, cat si de cresterea nivelului plasmatic a substantelor ce solubilizeaza uratul. Trebuie mentionat si faptul ca in ciuda unor concentratii asa de mari a uratului, uricaza este totusi capabila sa metabolizeze tot acidul uric.
Starea uratului la nivel plasmatic - liber sau legat - a constituit o controversa ce a durat foarte multi ani, unii cercetatori pretinzand ca uratul monosodic este legat majoritar de catre moleculele plasmatice, altii sustinand ca, dimpotriva, uratul se afla predominant liber plasmatic, intrucat este cu usurinta filtrabil. Unele laboratoare au raportat existenta unui procent scazut de 4-5% din urat ca fiind legat de proteinele plasmatice, valori ce sunt in concordanta cu rezultatele unor studii mai vechi in vitro, folosindu-se tehnica dializei. Aceste studii indica faptul ca legarea acidului uric de proteinele plasmatice la 37o C este scazuta si are o semnificatie aproape neglijabila.
4. Solubilitatea in urina
Pe masura ce urina primara sufera de-a lungul aparatului tubular renal un proces de acidifiere, o parte din uratul monosodic continut de acea urina se transforma in acid uric. Solubilitatea acidului uric in solutii apoase este sensibil mai mica decat cea a uratului. Astfel, la pH urinar = 5, urina este saturata cu acid uric la o valoare a acestuia de 15 mg/dl, in timp ce la un pH egal cu 7, cantitatea de acid uric dizolvat in urina creste pana la 158-200 mg/dl. Solubilitatea scazuta a acidului uric in urina la pH = 5 are o importanta deosebita in special la pacientii cu diverse afectiuni renale (acidoze tubulare) si extrarenale, care se insotesc de o urina acida. Totusi la orice pH urinar, solubilitatea uratului in urina este mai mare decat in apa; efectul de crestere al solubilitatii fiind atribuit ureei si diverselor proteine.
5. Forme cristaline
Uratul monosodic se transforma in monohidrat si formeaza cristale la nivel tisular si al lichidului sinovial. Acidul uric cristalizeaza in solutii pure sub forma rombica. Cristalele formate la nivel urinar incorporeaza si pigmenti diversi si au forme variate. Depozitele tisulare sunt compuse din urat monosodic monohidrat, iar calculii renali sunt in mare parte compusi din acid uric (datorita pH-ului acid). Atat cristalele de acid uric, cat si cele de urat monosodic prezinta fenomenul de birefringenta in lumina polarizata. Toate aceste trasaturi permit recunoasterea cu usurinta a cristalelor de urat in lichidul sinovial, leucocite, rinichi, depozite tisulare.
E. Clasificarea si patogenia hiperuricemiei
Concentratia serica a acidului uric variaza cu varsta si sexul. Copiii de ambele sexe, au concentratii serice de acid uric de aproximativ 3-4 mg/dl. La pubertate, baietii prezinta o crestere a concentratiei serice a acidului uric cu 1-2 mg/dl, pana la o valoare care este mentinuta relativ constanta in cursul vietii. La femei valoarea uricemiei, de 3-4 mg/dl, se mentine, cu mici modificari, neschimbata pana la menopauza, cand concentratia acidului uric in ser creste si incepe sa se apropie de valorile intalnite la barbatii adulti. Deoarece concentratia serica a uratului nu are o distributie de tip normal in populatie, existand o usoara tendinta spre valori mai crescute, este bine sa definim valorile normale ale acidului uric in functie de saturatia fizico-chimica a serului cu urat, care la 37o C, este in jur de 7 mg/dl.
In afara de existenta variatiilor nivelului acidului uric in functie de varsta si sex, trebuie amintit si faptul ca exista si variatii circadiene, intrucat excretia urinara de acid uric este scazuta noaptea si de asemenea exista si o variatie in functie de anotimp, cele mai mari valori ale uricemiei fiind observate in luniile iulie si august.
O definitie rigida a hiperuricemiei nu este posibila; astfel, in termeni generali si pentru considerente practice, limita superioara a normalului este considerata o valoare de 7 mg/dl, la concentratii mai mari aparand riscul de a dezvolta guta si nefropatie urica. Pe de alta parte, concentratia acidului uric la nivelul diferitelor compartimente ale organismului uman este determinata de existenta unui echilibru intre rata productiei si cea a eliminarii acidului uric.
Hiperuricemia poate fi datorata:
a. unei rate crescute a formarii acidului uric;
b. unei rate scazute de eliminare a acidului uric;
c. alti factori asociati cu hiperuricemia, al caror mecanism de actiune ramane incert.
Hiperuricemia poate fi clasificata in:
1. hiperuricemie prin cresterea sintezei de acid uric:
a. anomalii enzimatice specifice
activitate scazuta a HGPRT;
activitate scazuta a PRPP sintetazei;
deficit de glucozo 6-fosfataza;
activitate crescuta a glutation-reductazei;
intoleranta la fructoza.
b. turn-over crescut al nucleoproteinelor:
boli mieloproliferative: boala Hodgkin, leucemie, mielom multiplu, policitemie, metaplazie mieloida, hiperglobulinemia Waldenström, limfoblastom, limfosarcom, talasemie, etc;
psoriazis;
hemolize cronice;
sarcoidoza;
mononucleoza infectioasa.
c. aport crescut prin dieta.
2. hiperuricemie prin scaderea eliminarii de acid uric:
a. alterarea functiei renale;
b. acidoza lactica;
c. inanitie si cetoacidoza;
d. intoxicatie cu Pb;
e. mixedem;
f. tulburari renale tubulare:
sarcoidoza;
droguri, toxice (fructoza, digitala);
hiperparatiroidism cu hipercalcemie;
HTA;
idiopatic.
3. hiperuricemie prin modificarea raportului sinteza/eliminare.
Hiperuricemia mai poate fi clasificata, de asemenea, si in: primara, secundara si idiopatica.
Hiperuricemia primara, prin definitie, include acele cazuri de boala datorate unor anomalii metabolice genetice mostenite, ce nu se datoreaza unor conditii dobandite si nici unei anomalii genetice ce pot determina o boala predispozanta pentru hiperuricemie (talasemia).
Hiperuricemia secundara se refera la hiperuricemia care apare in evolutia altor boli sau este consecinta administrarii unor medicamente. Se considera ca aproximativ 30% din pacienti au hiperuricemie primara si aproximativ 70% au hiperuricemie secundara.
Hiperuricemia idiopatica include acele cazuri ce nu pot fi incluse in categoriile de mai sus.
Clasificarea hiperuricemiei
|
Tip |
Anomalia metabolica |
Transmitere |
|
1. Primara Defecte moleculare neprecizate a. hiperproductia de acid uric(10%) b. hipoexcretie de acid uric(90%) Asociata cu deficit enzimatic specific a. PRPP-sintetaza cu activitate crescuta b. deficit partial de HGPRT |
neprecizata neprecizata creste sinteza de PRPP si acid uric creste sinteza de acid uric; creste biosinteza purinica de nuovo |
poligenica poligenica X-linkata X-linkata |
|
2. Secundara Asociata cu cresterea biosintezei purinice de nuovo a. deficit complet de HGPRT b. deficit partial/complet de G6P-aza Asociata cu cresterea degradarii ATP Asociata cu cresterea turn-over-ului acizilor nucleici Asociata cu scaderea excretiei de acid uric |
↑ productia de acid uric; ↑ PRPP-sintetaza ↑ productiei cu ↓ eliminarii de acid uric; b. cu stocare de glicogen tip I (glicogenaza tipI von Gierke) creste productia de acid uric ↓ filtrarea de acid uric; inhibitia secretiei sau ↑ reabsorbtiei de acid uric |
X-linkata autozomal recesiva nefamilial autozomal dominant sau necunoscut |
|
3. Idiopatica |
necunoscuta |
necunoscuta |
O altfel de clasificare a hiperuricemiei, din punct de vedere etiopatogenic, poate fi sistematizata astfel:
1. hiperuricemia idiopatica (cresterea sintezei purinice de novo);
2. hiperuricemia de supraalimentatie;
3. hiperuricemia secundara altor afectiuni (boli renale sau mieloproliferative);
4. hiperuricemia tranzitorie (de post, ingestia masiva de bauturi alcoolice, dupa effort muscular intens);
5. hiperuricemia iatrogena (post medicamentoasa).
Hiperuricemia primara
La om exista doua cauze de hiperuricemie primara:
A. Cresterea productiei de acid uric (aproximativ 10% din cazuri);
B. Scaderea excretiei renale de acid uric (80-90% din cazuri).
A. Hiperuricemia primara cu supraproductie de acid uric
Aceasta forma de hiperuricemie se datoreaza, la randul ei, fie cresterii aportului alimentar de purine, fie cresterii biosintezei purinice de novo in urma unei anomalii metabolice. Supraproductia de acid uric este definita prin excretia a mai mult de 600 mg acid uric pe zi dupa o perioada de 5 zile de administrare a unei diete sarace in purine. Mai putin de 10% din pacientii cu guta au aceasta caracteristica.
De asemenea s-a sugerat ca nivelul supraproductiei de acid uric poate fi estimat si prin determinarea raportului intre acidul uric si creatinina excretate urinar sau raportului dintre clearence-ul celor 2 substante. Compararea acestor doua metode a aratat ca valoarea acidului uric excretat pe 24h se coreleaza foarte strans cu valorile obtinute prin compararea celor doua clearence-uri.
In cazul existentei unor deficite enzimatice specifice sau unor procese de liza celulara rapida, spre exemplu in tratamentul leucemiilor sau limfoamelor, exista o crestere substantiala a productiei de acid uric, raportul dintre acidul uric si creatinina urinara depasind 0.75, astfel incat devine necesar la majoritatea pacientilor sa se masoare cantitatea de acid uric excretata urinar in 24h pentru a avea o clasificare corecta.
La pacientii cu supraproductie de acid uric, hiperuricemia se datoreaza unor anomalii enzimatice congenitale, ce include:
deficitul de hipoxantin-guanin-fosforibozil-transferaza (HGPRT);
cresterea activitatii fosforibozil-pirofosfat-sintetazei (PRPP);
deficitul de glucozo-6-fosfataza.
Studii ulterioare au aratat ca in supraproductia de acid uric mai pot fi implicate si anomalii ale AMP-dezaminazei si un deficit de adenil-succinat-sintetaza, insa acestea n-au fost confirmate clinic.
Deficitul de hipoxantin-fosforibozil-transferaza (HGPRT)
In 1976 Seegmiller, Rosenbloom si Kelley au descoperit ca atat din eritrocitele, cat si din fibroblastii unor pacienti suferinzi de sindromul Lesch-Nyhan lipsea o enzima esentiala in metabolismul purinic, si anume HGPRT, care catalizeaza in mod normal transformarea hipoxantinei in xantina si a guaninei in acid guanilic si inozinic.
Boala Lesch-Nyhan este o maladie genetica rara, cu transmitere X-linkata si cu manifestari numai la sexul masculin, copiii afectati dezvoltand inca de la nastere un sindrom caracterizat prin miscari coreoatetozice si spasticitate ce dureaza pana la varsta copilariei. Boala este determinata de absenta completa a activitatii HGPRT si la nivelul altor tesuturi in afara de eritrocite, fiind caracterizata din punct de vedere metabolic prin hiperuricemie marcata, productie excesiva de acid uric si cristalurie, iar din punct de vedere clinic spasticitatea si coreoatetoza se asociaza cu retard mental si tendinta crescuta de automutilare ce necesita legarea bolnavului sau chiar extractii dentare pentru a preveni muscarea buzelor si a degetelor. De asemenea, deficienta mentala se pare ca s-ar datora si unei dizartri asociate. Comportamentul agresiv al pacientului este intreptat atat impotriva sa, cat si impotriva anturajului, dar este in mod paradoxal combinat cu o personalitate prietenoasa (pacientul isi realizeaza si isi regreta comportamentul).
In unele situatii (intalnite destul de rar in practica), eritrocitele bolnavilor cu sindrom Lesch-Nyhan, desi nu prezinta o activitate detectabila a HGPRT, pot prezenta totusi reactii incrucisate cu anticorpi antiHGPRT. Acest lucru demonstreaza ca la nivelul eritrocitelor acestor bolnavi sunt prezente cantitati normale de HPGRT, insa aceasta este inactiva datorita existentei unor mutatii la nivelul genelor ce codifica sinteza HGPRT. Prin diferite tehnici (clonare, PCR, amplificare genica si evidentiere directa a mutatiilor genelor respective) au fost identificate peste 50 de mutatii diferite ale genelor responsabile de sinteza HGPRT (deletii, recombinari, substitutii de baze).
Exista, de asemenea, si o categorie de pacienti care au doar un deficit partial al activitatii HGPRT. Acesti pacienti prezinta, din punct de vedere clinic, calculi renali de acid uric, episoade de artrita gutoasa, insa fara a avea modificari neurologice si tulburari de comportament ce sunt caracteristice sindromului Lesch-Nyhan. Acest sindrom, caracterizat de deficienta partiala a HGPRT, poarta numele de sindrom Kelley-Seegmiller.
Pacientii cu sindrom Kelley-Seegmiller prezinta o sinteza crescuta de acid uric, care se coreleaza cu o eliminare crescuta de acid uric, raportata la greutatea lor corporala (pana la 36 mg/kgc/zi, normalul avand valoarea de 10-18 mg/kgc/zi). Multi pacienti prezinta episoade de cristalurie din cauza cresterii excesive a excretiei de acid uric. Aceste simptome, asociate cu nefrolitiaza uratica pot duce, in cazuri severe, la nefropatie obstructiva, cu instalarea insuficientei renale cronice si a azotemiei, acestea survenind cu o incidenta ce creste proportional cu varsta pacientului si cu intarzierea instituirii unei terapii. Valoarea uratului seric la acesti pacienti se situeaza intre 7 si 18 mg/dl in absenta afectarii renale (insuficientei renale). Ocazional (mai ales la pubertate) aceste valori pot fi in limite normale.
La nivelul eritrocitelor acestor pacienti s-au descoperit modificari de tip macrocitar, modificari inregistrate si la nivelul maduvei osoase, desi, in absenta unui sindrom anemic frust, cauzele acestor modificari sunt inca neelucidate. Nivelul activitatii HGPRT la nivelul eritrocitelor sau limfocitelor B este similar in randul membrilor aceleiasi familii, dar exista diferente mari intre membrii din familii diferite, activitatea HGPRT situandu-se intre 0.01 si 70% din valoarea normala. De asemenea s-au descoperit si unele forme de HGPRT cu o termolabilitate crescuta.
Productia excesiva a acidului uric, caracteristica deficitului partial de HGPRT, are la baza o accelerare a ratei biosintezei purinice de novo, acest lucru avand la baza 3 mecanisme:
1. Sinteza scazuta de acid guanilic si inozinic (GMP si IMP) duce la o suprimare a mecanismului de inhibitie a biosintezei purinice de novo (in mod normal GMP si IMP au un rol deosebit de important in acest mecanism). Desi incercarile de a masura nivelul intracelular al GMP si IMP au o valoare limitata (GMP si IMP au un nivel foarte scazut), s-a putut totusi observa ca pacientii cu sindrom Lesch-Nyhan prezinta o depletie severa a GMP intraeritrocitar, acest deficit fiind prezent si in eritrocitele unui pacient cu deficit de PRPP-sintetaza.
2. Scadera utilizarii, urmata de o crestere a concentratiei de PRPP, ceea ce duce la o sinteza purinica accelerata, intrucat nivelul celular crescut de PRPP favorizeaza scindarea PRPP-aminotransferazei in subunitatile sale active. In acest fel are loc o crestere a substratului enzimatic pentru enzima ce catalizeaza reactia limitanta de viteza a acestei cai si anume amidofosforiboziltransferaza (APRT). Prin urmare, alterarea concentratiei de PRPP pare sa fie cel mai important factor responsabil pentru cresterea sintezei purinice de novo asociata cu deficit de HGPRT.
3. Scaderea reutilizarii hipoxantinei ca urmare a scaderii activitatii HGPRT duce la utilizarea hipoxantinei pe singura cale metabolica posibila si anume oxidarea sa cu transformare in acid uric. Scaderea reutilizarii hipoxantinei duce la o scadere a consumului de PRPP cu cresterea concomitenta a concentratiei sale intracelulare.
La fel ca si hipoxantina si guanina si alte purine pot constitui substrat pentru actiunea HGPRT. Astfel, alopurinolul, in afara de efectul sau inhibitor asupra xantin-oxidazei, poate fi transformat in ribonucleotidele sale sub actiunea sincrona a HGPRT si PRPP, putand, astfel, exercita un efect de feed-back negativ asupra sintezei purinice, fapt demonstrat prin reducerea semnificativa a excretiei totale a purinelor. Totusi, studii actuale au pus la indoiala efectul alopurinolului de a produce o scadere substantiala a productiei de purine endogene si s-a emis ipoteza ca efectul sau este relativ scazut in cazul unei diete lipsite de purine. Astfel, scaderea eliminarii urinare de acid uric este contracarata de o crestere corespunzatoare a eliminarii de oxipurine (xantina si oxipurina), astfel ca purinele eliminate urinar raman neschimbate, efectul principal al alopurinolului manifestandu-se la nivelul absorbtiei purinelor alimentare.
8-azaguanina si 6-mercaptopurina sunt tot analogi purinici si pot reprezenta la randul lor substrat pentru actiunea HGPRT, folosirea lor fiind insa dependenta de existenta unei activitati normale a HGPRT.
Transmitera genetica a deficitului de HGPRT este X-linkata, boala manifestandu-se la barbati, femeile fiind doar purtatoare. Din punct de vedere al activitatii enzimatice, heterozigotii prezinta mozaicisme, fiind demonstrata, prin culturi de fibroblasti si clonare, existenta a doua populatii celulare - o populatie normala si o populatie lipsita de activitate enzimatica, ceea ce duce la aparitia unor anomalii biochimice minore, de regula clinic asimptomatice. La o parte din pacientii heterozigoti a fost decelata o concentratie serica crescuta de urat, iar un alt grup de pacienti a prezentat o excretie urinara crescuta de acid uric, nivelul seric fiind normal.
Studiul hartilor cromozomiale au aratat ca genele care codifica sinteza HGPRT se gasesc pe bratul lung al cromozomului X, in vecinatatea locusurilor responsabile pentru sinteza PRPP si G-6PDH.
Heterozigotii pentru acest defect pot fi detectati prin determinari enzimatice la nivelul foliculilor pilosi, iar diagnosticul prenatal poate fi facut prin efectuarea amniocentezei, prin biopsie corionica, chiar intr-un stadiu precoce al sarcinii. Mai nou s-au folosit si tehnici de AND recombinat.
Desi anomaliile metabolismului purinic au fost bine studiate si intelese, atat in cadrul sindromului Lesch-Nyhan, cat si al sindromului Kelley-Seegmiller, totusi patogenia anomaliilor neurologice, ce constituie de altfel principala caracteristica a sindromului Lesch-Nyhan, ca si patologia anemiei megaloblastice, inhibata in acest sindrom, raman totusi neclare. Acidul uric in sine nu poate fi considerat o cauza a manifestarilor neurologice, intrucat nivelul acidului uric in LCR este normal pe de o parte, iar pe de alta parte tratamentul antihiperuricemic administrat nu are efecte secundare asupra SNC.
Xantina si hipoxantina au fost intr-adevar gasite in cantitati crescute la nivelul LCR, atat la pacientii cu sindrom Lesch-Nyhan, cat si la pacientii cu deficit partial de HGPRT, la care insa manifestarile neurologice sunt aproape total absente. In schimb, la pacientii cu sindrom Lesch-Nyhan, a fost decelata existenta unei activitati plasmatice crescute a dopamin-β-hidroxilazei cu raspuns presor absent la stimularea simpatica, in timp ce la toti acesti pacienti au fost descoperite concentratii ridicate de aminoacizi liberi la nivel cerebral, ceea ce duce la scaderea formarii precursorilor esentiali pentru neurotransmitatori si de asemenea la scaderea sintezei proteice.
Tot aceste alterari ale nivelurilor aminoacizilor liberi de la nivel cerebral pot contribui la scaderea nivelului de catecolamine din ganglionii bazali.
Tratamentul pacientilor cu sindrom Lesch-Nyhan este adesea dificil, deoarece, desi productia excesiva de urat si consecintele sale sunt controlate de alopurinol, acesti bolnavi sunt foarte sensibili la actiunea acestuia, mai ales daca prezinta si un anumit grad de insuficienta renala, astfel incat dozele trebuie ajustate cu grija pentru a preveni formarea calculilor de xantina sau oxipurinol sau aparitia unei anemii aplastice ce poate fi rezultatul unei retentii excesive de oxipurinol in conditii de insuficienta renala. Trebuie mentionat de asemenea ca nu exista un tratament adecvat pentru tulburarile neuronale din cadrul acestui sindrom, fiind insa in studiu o metoda de transfer de AND/cromozomi ce codifica sinteza HGPRT la pacientii deficienti. Din punct de vedere al implicatiilor imunologice ale acestei boli, s-a constatat ca ea se asociaza cu cu niveluri scazute de limfocite B si, de asemenea, cu niveluri scazute de hemaglutinine, ceea ce sugereaza faptul ca reactiile biochimice catalizate de HGPRT pot avea un rol in formarea si functia limfocitelor B, fapt insa neconfirmat pana in prezent. In final, trebuie mentionat ca s-a evidentiat o grupa de pacienti cu simptoame identice cu cele ale ale persoanelor cu sindrom Lesch-Nyhan, la care insa fibroblastii si eritrocitele prezinta o activitate normala a HGPRT.
Activitatea crescuta a PRPP-sintetazei
Cresterea activitatii PRPP-sintetazei, cu cresterea consecutiva a PRPP a fost initial considerata ca si cauza de supraproducerea de acid uric si guta. Astfel au fost identificate mai multe forme ale enzimei (cel putin trei), fiecare dintre acestea prezentand o sensibilitate la inhibitorii ADP si GDP si de asemenea, prezentand o activitate enzimatica crescuta, concomitent cu cresterea afinitatii pentru riboza-5-fosfat. In anumite familii a fost intalnita si o forma severa a acestui defect enzimatic, cu debut precoce in copilarie si cu manifestari de retard psihic, surditate de transmitere congenitala, asociata cu supraproductua de purine.
Cel mai frecvent insa, in cadrul acestui defect, boala afecteaza doar persoanele de sex masculin, ce prezinta semne clinice de guta, cu debut in jurul varstei de 21-39 ani. O parte dintre pacienti prezinta antecedente de dializa renala, mai ales in formele cu debut sub 18 ani. Hiperuricemia inregistrata la acesti pacienti este cuprinsa intre 9.6-13.6 mg/dl, iar excretia urinara de acid uric intre 950-2400 mg/24h.
PRPP-sintetaza este codificata de gene existente la nivelul cromozomului X (ca si HGPRT), ceea ce face ca transmiterea boalii sa fie de asemenea X-linkata. Aceasta transmitere X-linkata explica si faptul ca aceasta boala afecteaza doar barbatii, femeile fiind heterozigote, prezentand doar o crestere moderata a sintezei de acid uric, crestere compensata printr-o excretie urinara crescuta de acid uric.
Hiperuricemia primitiva cu supraproductie de acid uric se mai poate datota si cresterii aportului alimentar de purine in afara de cauzele cresterii sintezei purinice de novo. Rolul aportului alimentar rezida foarte clar din studiile efectuate in care s-a observat o rata scazuta a bolii in perioada razboaielor si o aparitie a crizelor gutoase frecvent dupa mese bogate, cu continut mare de purine, lipide si alcool - acesta din urma determinand o crestere a sintezei de acid uric si o scadere a excretiei sale tubulare. S-a constatat ca astfel ca un consum de 4g ARN zilnic duce la dublarea nivelului seric de acid uric si la cresterea turn-over-ului sau, ceea ce sugereaza si existenta unui clearence crescut al acestuia. Pe de alta parte sinteza purinica endogena nu este inhibata de aportul alimentar ridicat de purine, desi o dieta lipsita de purine produce o scadere a nivelului seric de urat in medie cu 1 mg/dl.
Hiperuricemia bautorilor de bere se pare ca s-ar datora, in parte, si ingestiei de azot purinic, derivat din bere, ceea ce duce la o crestere a efectului hiperuricemic al alcoolului insusi.
Cresterea productiei de acid uric in urma distructiei excesive de celule
Acest mecanism de producere al hiperuricemiilor este intalnit in bolile mielo- si limfoproliferative. De asemenea si tratamentul acestor boli duce la cresterea sintezei de acid uric.
Orice crestere a ratei de proliferare a celulelor de orice tip va duce la cresterea sintezei si degradarii purinelor. Astfel, pool-ul miscibil de urat va creste, avand drept rezultat hiperuricemie, iar in prezenta unei functii renale normale-hiperuricozurie. In mod caracteristic, hiperproductia de purine apare in bolile proliferative ale seriei mieloide si limfoide, dar hiperuricemia poate de asemenea sa apara in psoriazis si in metastazele multiple ale tumorilor solide.
Hiperurocemia este frecventa in policitemia vera si metaplazia mieloida. In leucemia acuta mieloida si in cea limfoida valorile serice ale acidului uric pot depasi 20 mg/dl si, in acest caz, poate aparea precipitarea cristalelor de acid uric in tubii renali, eventual cu apritia insuficientei renale acute. Peste 50% din pacientii cu leucemie mieloida cronica au hiperuricemie care este insa rara la pacientii cu leucemie limfatica cronica. Mielomul multiplu este frecvent asociat cu hiperuricemia, dar la aceasta mai poate contribui si insuficienta renala. Hiperuricemia este neobisnuita in bolile primare ale eritrocitelor, dar se poate intalni in siclemie, talasemia, alte anemii hemolitice si in eritrocitozele secundare.
B. Scaderea excretiei renale de acid uric
S-a constatat inca demult ca scaderea excretiei renale de acid uric poate fi una din cauzele de hiperuricemie, ea fiind asociata cu cresterea productiei de acid uric la 80% din pacientii cu guta, in timp ce doar, in timp ce doar 20% din bolnavi au la baza bolii numai cresterea productiei de acid uric, neinsotita de diminuarea excretiei acestuia. Astfel, s-a observat ca la majoritatea pacientilor cu hiperuricemie, raportul intre clearence-ul la urat si cel la inulina este mai mic decat in cazul subiectilor sanatosi, acest raport avand insa tendinta de a creste, atat in randul pacientilor cu hiperuricemie, cat si in randul subiectilor sanatosi, dupa ingestia de alimente bogate in nucleoproteine sau dupa administrarea de urat, dar in cazul bolnavilor era nevoie de o doza mai mare de purina pentru a atinge acelasi raport ca in cazul indiviziilor sanatosi.
Exista, totusi, o mare asemanare intre valorile clearence-ului pentru urat la oamenii sanatosi si la cei hiperuricemici. Gutman a evidentiat inca din 1957 un clearence pentru acid uric 8.7 ml/min la persoanele sanatoase si doar putin scazut (7.5 ml/min) la pacientii hiperuricemici, desi, asa cum am aratat, pentru un nivel plasmatic similar de acid uric, clearence-ul acidului uric este mai mic la pacientii cu hiperuricemie si mai mare in cazul subiectilor sanatosi.
Teoretic, modificarea curbei de excretie a uratului la pacientii cu hiperuricemie poate fi datorata:
1. reducerii filtrarii glomerulare a acidului uric;
2. cresterii reabsorbtiei acidului uric;
3. scaderii secretiei acidului uric,
precizarea exacta a sediului defectului nefiind inca posibila.
1. filtrarea glomerulara
O ipoteza ce mai trebuie cercetata este cea a legarii acidului uric de proteinele plasmatice, legare ce s-ar produce atunci cand nivelul seric al acidului uric creste, aceasta legare avand drept urmare scaderea filtrarii glomerulare a acidului uric.
De asemenea, clearence-ul uratului scade odata cu scaderea filtrarii glomerulare, existand totusi o crestere relativa a eliminarii de urat in cazul pacientilor cu insuficienta renala, deoarece, odata cu excluderea functionala a unui anumit numar de nefroni are loc o crestere a excretiei de urat la nivelul nefronilor restanti.
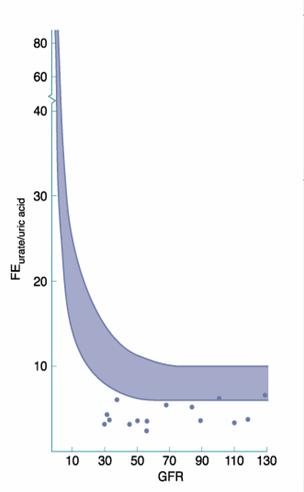
fractia excretiei uratului in diferite grade de insuficienta renala
fractia excretiei uratului creste rapid, pe masura ce rata filtrarii glomerulare scade, in paralel cu excretia sodiului si un numar de alti solviti, atingand 85% sau mai mult din uratul filtrat in insuficienta renala severa; acest lucru impreuna cu uricoliza servesc la limitarea cresterii uratului seric.
Punctele din figura reprezinta date de la pacientii cu nefropatie urica juvenila, ilustrand fractia excretorie foarte joasa a acestor pacienti , mai ales in relatie cu functia renala foarte deteriorata a acestora.
Totusi, valoarea absoluta a excretiei de urat in 24 h scade concomitent cu scaderea filtrarii glomerulare si este posibil ca un procent insemnat din productia de urat sa fie excretat pe cale extrarenala la pacientii cu insuficienta renala. Astfel, uricemia la acesti pacienti nu are o crestere progresiva asa cum se inregistreaza in cazul creatininei si ureei, iar uratul seric depaseste rareori valoarea de 10 mg/dl in insuficienta renala cronica stabila daca nu exista si alti factori asociati, cum ar fi administrarea anumitor medicamente sau HTA necontrolata.
2. reabsorbtia tubulara
Reabsorbtia tubulara a acidului uric are un rol foarte important in stabilirea nivelului seric de acid uric, ea putand sa fie de 100% din valoarea filtrarii glomerulare
Un factor important legat de reabsorbtia acidului uric este cotransportul cu sodiu. Astfel, expansiunea sau contractia sectorului lichidian extracelular va inhiba, respectiv va creste reabsorbtia tubulara proximala a sodiului si a acidului uric.
3. secretia tubulara
La anumiti pacienti s-a descoperit ca principala cauza a hiperuricemiei este scaderea secretiei tubulare, fara a exista si o crestere a productiei de urat asociata. Prin folosirea testului de supresie cu pirazinamida, care inhiba selectiv secretia tubulara a acidului uric, s-a demonstrat existenta acestei categorii subexcretoare de pacienti. Interpretarea acestui test, insa, se face in mod diferit; astfel, o asa zisa scadere a secretiei se pare ca are totusi la baza reabsorbtie la nivel distal fata de locul secretiei acidului uric. Este fara indoiala faptul ca exista si situatii in care scaderea secretiei renale de acid uric poate duce la hiperuricemie. Astfel, s-a utilizat administrarea de benziodarona - inhibitor selectiv al reabsorbtiei tubulare a uratului rezultat prin secretie tubulara si in urma acestui test uricozuria indusa poate fi cinsiderata ca rata minima secretorie; in final, s-a observat ca pacientii cu guta, dar cu productie normala de acid uric au o rata de secretie renala a acidului uric semnificativ mai mica decat pacientii cu supraproductie de acid uric.
In concluzie, se pare ca in timp ce unii pacienti cu hiperuricemie primara prezinta o anomalie genetica bine definita la majoritatea pacientilor, hiperuricemia are o etiologie multipla, existand modificari calitative si cantitative ale metabolismului si functiei renale ce sunt genetic determinate, la care se adauga efectul diversilor agenti externi, in mod special cei alimentari (aport energetic, cat si purinic)
Se poate spune, in concluzie, ca hiperuricemia primara este de cele mai multe ori familiala si ereditara, deoarece s-a observat ca 1/3 din rudele pacientilor cu hiperuricemie prezinta la randul lor hiperuricemie. Este importanta, de asemenea, si mentiunea ca foarte frecvent hiperuricemia primara se asociaza foarte frecvent cu ateroscleroza, HTA, obezitate si diabet zaharat.
|
Factori endogeni Factori exogeni |
|
Factori care scad excretia renala de acid uric - lactat - salicilat (doze mici) - β-hidroxibutirat - pirazinamida - acetoacetat - acid nicotinic - etambutol - plumb - beriliu - diuretice - ciclosporina Factori care cresc excretia urinara de acid uric - sarcina - infuzia salina - sulfinpirazona - benzobromarona - fenilbutazona - probenecid - vitamina C in doze f.mari - salicilati in doze mari(>3g) |
Hiperuricemia secundara
Din punct de vedere fiziopatologic trebuie avute in vedere, in cadrul hiperuricemiei secundare, 1. atat mecanismul renal de excretie a acidului uric, ce poate fi deficitar din cauza a diverse tulburari, 2. cat si cazurile de hiperuricemie secundara aparute ca urmare a supraproductiei de acid uric.
1. alterari ale functiei renale si ale volumului plasmatic
Clearence-ul renal pentru urat este legat de schimbarile ce apar la nivelul fluxului plasmatic renal, o reducere a acestuia putand fi asociata cu hiperuricemie, asa cum se observa dupa administrarea de angiotensina/noradrenalina sau la pacientii cu diabet insipid. Excretia de acid uric variaza direct proportional cu fluxul sangvin renal si cu debitul urinar si de asemenea, o crestere sau o scadere a volumului lichidului extracelular influenteaza procesele renale de eliminare a uratului. Cresterea volumului extracelular este asociata cu scaderea marcata a reabsorbtiei acidului uric, in timp ce scaderea lichidului extracelular duce la retentie de acid uric, fapt ce explica efectul hiperuricemiant al terapiei cu diuretice.
O serie de substante sunt cunoscute ca avand efect hiperuricemiant, prin scaderea eliminarilor de acid uric la nivel renal. Pirazinamida si forma sa dezaminata, acidul pirazinoic, sunt inhibitori puternici ai secretiei tubulare renale de acid uric. Si etambutolul, un alt tuberculostatic, scade clearence-ul renal al acidului uric. Acidul nicotinic, care structural este similar cu acidul pirazinoic, scade si el excretia renala a acidului uric. In plus, acidul uric intra in competitie cu alti acizi organici pentru secretia din sange in lumenul tubular. Astfel, secretia acidului uric poate fi puternic influentata de prezenta unor acizi organici slabi din productia endogena, ca de exemplu: acid lactic, acid β-hidroxibutiric sau acidul aceto-acetic. In acest mod, hiperlactacidemia este un factor important in producerea hiperuricemiei dupa ingestia de alcool, din timpul toxemiei gravidice si din boala depozitelor de glicogen si eforturile fizice intense. Hiperuricemia din acidoza diabetica si din inanitie este determinata de cresterea acidului β-hidroxibutiric.
Medicamentele care au structura de acizi organici slabi interfera de asemenea cu secretia de acid uric. Astfel, acidul acetilsalicilic, in doze mici de pana la 2 g/zi, poate creste concentratia plasmatica a uratului, dar in doze mari, de 2 g/zi, este in general uricozuric. Acest efect paradoxal se datoreaza faptului ca dozele mici inhiba preferential secretia tubulara, iar dozele mari inhiba preferential reabsorbtia acidului uric.
Diureticele sunt medicamentele care produc cel mai frecvent hiperuricemie. Desi mecanismul prin care diureticele produc hiperuricemie nu este clar, acesta poate implica fie cresterea reabsorbtiei acidului uric in tubul proximal, fie scaderea secretiei tubulare sau cresterea reabsorbtiei postsecretorii a acidului uric. Spironolactona este singurul diuretic care nu produce hiperuricemie.
O alta asociere arhicunoscuta este aceea intre intoxicatia cronica cu plumb, hiperuricemie si guta. Cresterea acidului uric, in acest caz, se datoreaza unui defect in secretia tubulara a uratului. Alta actiune a Pb este aceea de a inhiba guanaza, enzima responsabila pentru dezaminarea hidrolitica a guaninei la xantina.
Hiperuricemia poate apare de asemenea in hipotiroidie, hiperparatiroidie si hipoparatiroidie. Aceste boli produc hiperuricemie probabil prin reducerea excretiei renale de urat.
2. supraproductia de acid uric in hiperuricemia secundara
Exista numeroase cauze de hiperuricemie secundara asociate cu o crestere a productiei de acid uric, la care o crestere eventuala a excretiei este plafonata.
Pacientii cu deficit de glucozo-6-fosfatoza (glicogenoza de tip I von Gierke) prezinta o crestere a producerii de acid uric, ca si o rata crescuta a biosintezei purinice de novo, asociata cu hiperuricemie si artrita gutoasa. Cauza principala a cresterii sintezei acidului uric pare a fi o degradare a ATP ce apare in cursul hipoglicemiei, datorate degradarii glicogenului hepatic pana la polizaharide fosforilate, in absenta G6PDH. Pe de alta parte hiperuricemia din aceasta boala se poate datora si unei inhibitii competitive a secretiei tubulare de urat de catre lactat si de catre compusii cetonici.
Alta cauza a hiperuricemiei rezida in faptul ca deficitul de G6PDH lasa o anumita cantitate de glucozo-6-fosfat neutilizata, cantitate ce este convertita in riboza-5-fosfat, aceasta reprezentand substratul PRPP-sintetazei, avand drept consecinta cresterea PRPP cu hiperuricemie secundara.
Si hipoglcemia poate determina cresterea productiei de acid uric, glicogenul folosit pentru sinteza de glucoza ducand la cresterea cantitatii de ATP cu degradarea acestuia la acid uric. De asemenea, chiar si consumul de alcool duce la hiperuricemie prin cresterea degradarii ATP-ului la acid uric. Acest mecanism pare a interveni si in cazul pacientilor cu boli acute, infarct miocardic acut sau intoxicatie cu tutun.
Exercitiul fizic prelungit, pe langa inhibitia eliminarii renale de urat ca urmare a cresterii sintezei de lactat, produce si o degradare crescuta a ATP-ului muscular, fapt ce are ca rezultat o crestere a sintezei de acid uric. Acest mecanism este valabil si in cazul statusului epilepticus.
Si in cazul hiperuricemiei din glicogenozele de tip III, tip V (deficit de miofosforilaza), tip VII (deficit de fosfofructokinaza la nivel muscular) tot degradarea ATP-ului muscular este raspunzatoare de crestera acidului uric seric, degradare secundara scaderii formarii substratului glucidic necesar sintezei ATP.
Exercitiul fizic, chiar si moderat, efectuat in conditii de ischemie creste degradarea ATP cu formarea de inozina, xantina si hipoxantina, degradarea acestor compusi pana la acid uric putand duce la hiperuricemie.
O alta situatie in care apare hiperuricemie secundara datorita unui defect enzimatic este si cresterea activitatii glutation-reductazei. Acesta este un defect genetic cu transmitere autozomal-recesiva, ce apare mai ales la populatia neagra, datorita unei cresteri a activitatii suntului pentozo-fosfatilor, cu cresterea consecutiva a cantitatii de riboza-5-fosfat, PRPP si acid uric, si manifestata clinic prin hiperuricemie si guta.
Majoritatea pacientilor cu hiperuricemie secundara caracterizata prin supraproductie de acid uric, au la baza turn-over-ul crescut al acizilor nucleici, situatie ce apare in unele boli mielo- si limfoproliferative, mielom multiplu, policitemie, anemie pernicioasa, diverse hemoglobinopatii (talasemii, anemii hemolitice), mononucleoza infectioasa, unele carcinoame, toate acestea fiind asociate cu cresterea activitatii medulare si cu cresterea turn-over-ului celular la nivelul altor tesuturi. La acesti pacienti excretia renala a acidului uric este crescuta, atingand valori de 634 mg/dl, fata de 497 mg/dl valoarea normala.
Hiperuricemia secundara a fost intalnita si in unele tipuri de leucemie, mielomatoza, siclemie, policitemii secundare datorate unor boli cardiace sau respiratorii sau unor tumori renale, precum si la unii pacienti cu psoriazis, gradul hiperuricemiei corelandu-se cu gradul extensiei cutanate a acestei boli si cu incorporarea masiva a 14C-glicinei in acidul uric urinar, ceea ce indica faptul ca responsabil pentru hiperuricemia asociata psoriazisului este un turn-over crescut al acizilor nucleici de la nivelul leziunilor cutanate, desi se pare ca nu exista o legatura cantitativa directa.
Rata biosintezei purinice mai poate fi crescuta si prin administrarea anumitor substante chimice sau medicamente pentru diverse alte afectiuni:
2-etilamino-1,3,4 tiadiazolul este un compus folosit experimental in terapia cancerului. Mecanismul prin care acest compus se face raspunzator de cresterea nivelului plasmatic al acidului uric este cresterea marcata a PRPP la nivelul celulei hepatice;
prezenta albastrului de metilen la nivelul eritrocitelor sau a altor celule duce la cresterea productiei de riboza-5-fosfat si in consecinta de PRPP;
administrarea de fructoza duce la hiperuricemie si la cresterea excretiei de acid uric ca o consecinta a consumului de ATP in reactia de fosforilare a fructozei, reactie ce duce secundar la o scadere a adenil-nucleotidelor prin conversia AMP in IMP si mai departe la produsi de catabolism.
Consecintele hiperuricemiei
Dupa artrita gutoasa, afectarea renala este cea mai frecventa complicatie a hiperuricemiei. Trei tipuri de boli renale sunt asociate cu hiperuricemia. Primul tip poarta numele de nefropatie uratica, nefropatie hiperuricemica cronica sau rinichi gutos si se produce prin depozitarea de cristale de urat monosodic in interstitiul renal. Se crede ca aceasta afectiune se datoreaza hiperuricemiei cronice. Al doilea tip poarta denumirea de nefropatie acid urica si este produsa prin depozitarea cristalelor de acid uric in tubii colectori, bazinet sau ureter si afecteaza scurgerea urinii. Aceasta boala este produsa de cresterea concentratiei acidului uric in urina si se poate prezenta fie ca nefropatie acid urica, fie ca litiaza urica. Al treilea tip de afectare renala il reprezinta litiaza oxalo-calcica care apare mult mai frecvent la pacientii cu hiperuricemie sau guta decat la pacientii normouricemici.
Acest mod de prezentare este dictat, intr-o mare masura, de proprietatiile chimice ale acidului uric. Astfel, deoarece pKa al acidului uric este 5.75 (pKa este pH-ul la care jumatate din substanta este disociata, iar cealalta jumatate nedisociata), peste 95% din acidul uric se afla in sange (pH = 7.4) in forma disociata de ioni de urat. Din acest motiv, este mai adecvat sa vorbim despre concentratia uratului decat de concentratia acidului uric in plasma, filtrat glomerular si interstitiu renal. Deoarece uratul este concentrat in medulara renala prin mecanismul multiplicator contracurent, similar cu sodiul, prezenta cristalelor de urat amorf este de asteptat in medulara renala atunci cand nivelul seric al uratului depaseste limita de saturatie. Invers, la pH inferior al urinii din nefronul distal, o mare proportie de acid uric se afla in forma nedisociata. Astfel, in conditiile in care concentratia urinara a acidului uric este ridicata, iar pH-ul urinii este scazut, cristalele de acid uric pot fi gasite in lumenul tubilor colectori sau in caile urinare inferioare. Confirmarea acestei supozitii a fost obtinuta prin studiile de difractie a razelor X. Cristalele din tofii periferici si din tesutul renal la pacientii cu nefropatie gutoasa sunt din urat de sodiu, pe cand cristalele din calculii situati in lumenul tubular al pacientilor cu leucemie limfatica acuta sunt din acid uric.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








