
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Cercetare - implicatiile fiziopatologice ale presiunii intra-abdominale |
Cercetare - implicatiile fiziopatologice ale presiunii intra-abdominale
1. SCOPUL STUDIULUI CLINIC
1.1. Problema majora de cercetare. Obiective.
Cu toate ca implicatiile fiziopatologice ale presiunii intra-abdominale au fost observate inca de acum 150 de ani, implicatiile fiziopatologice ale presiunii intra-abdominale crescute (PIA) au fost de fapt redescoperite doar in deceniul trecut. In occident si din pacate mai putin in tara noastra, PIA crescuta sau 'Hipertensiunea intra-abdominala' (HIA) este acum in mod obisnuit identificata la pacientii critici, si recunoscuta drept cauza a unei morbiditati si mortalitati semnificative.
HIA a fost recunoscuta ca un sir de modificari fiziopatologice incepand cu perturbarea fluxului sanguin regional si in final culminand cu insuficienta multiorganica indusa de IAP, denumita 'Sindrom de compartiment abdominal' (ACS).
Deasemenea incidenta crescuta a HIA/SCA in compartimentele de terapie intensiva cat si implicatiile fiziopatologice grave, impun identificarea si tratarea cat mai precoce a acestui sindrom pentru ameliorarea prognosticului si scaderea mortalitatii. Un studiu epidemiologic multicentric recent a descoperit ca HIA (definita ca PIA≥12 mmHg) a fost prezenta la 51% din pacientii medicali si chirurgicali de la terapie intensiva (TI), iar SCA (definita ca PIA≥20 mmHg cu una sau mai multe insuficiente de organ) a fost gasit la 8%.
In lumina acestor aspecte, consider ca orice aport adus la o mai buna cunoastere a implicatiilor hipertensiunii arteriale si sindromului de compartiment abdominal sunt binevenite.
Din aceste considerente am conturat obiectivele principale ale acetei teze de doctorat. Acestea sunt:
1-promovarea cunostintelor in randul cadrelor medicale privind HIA/SCA si imbunatatirea supravietuirii pacientilor
2-realizarea unui scor de evaluare a pacientilor cu HIA/SCA util atat pentru facilitatea punerii diagnosticului cat si pentru monitorizarea in dinamica a acestora si conturarea unui prognostic privind mortalitatea.
3- x tinta= scaderea mortalitatii data de SCA bla
Primele doua obiective sunt oarecum legate intre ele prin faptul ca nerecunoasterea acestui sindrom este legata in primul rand de numarul mic de aparitie al lucrarilor privind HIA/SCA in tara noastra si in al doilea rand lipsa unui protocol standardizat privind diagnosticul si managementul HIA/SCA.
Cu toate ca exista mai multe recomandari privind diagnosticul si tratamentul HIA/SCA, acestea sunt rezultatul unor studii care au vizat separat diferite aspecte, in special efecte fiziopatologice ale HIA sau modalitati de masurare a PIA, insa, probabil din cauza datelor insuficiente sunt inca multe lacune privind monitorizarea eficienta a pacientilor cu HIA/SCA. Pe de alta parte in literatura medicala romaneasca nu exista decat cateva comunicari sau articole cu informatii preluate din literatura medicala internationala si nici un studiu clinic.
Atat lipsa de informatii cat si faptul ca HIA este greu de descoperit numai prin examenul fizic, complica si mai mult diagnosticul si managementul acestor pacienti critici. Deasemenea PIA crescuta poate usor sa ramana nedescoperita, rezultand o importanta disfunctie si insuficienta organica.
1.2. Plasarea problemei abordate in contextul cunostiintelor stiintifice actuale. Limitele literaturii de specialitate.
Cercetarile efectuate pana in acest moment cu privire la PIA/HIA/SCA au dus la conturarea unor clasificari. In prima faza s-a crezut ca acestea pot oferi datecuprinzatoare privind starea pacientului.
Din studiile si comunicarile care au vizat masurarea PIA s-a stabilit o clasificare a PIA in functie de valoarea ei cu implicatii clinice locale sau sistemice:
Gradul 1 -PIA intre 12-15 mmHg
Gradul 2 -PIA intre 16-20 mmHg
Gradul 3 -PIA intre 21-25 mmHg
Gradul 4 -PIA >25 mmHg
Deasemenea s-a facut si o clasificare a HIA in functie de durata simptomatologiei:
-a- HIA cronica
-b- HIA acuta
-c- HIA subacuta
-d- HIA hiperacuta
Totodata s-au schitat si catea indicatii terapeutice in functie de valoarea HIA. Se considera ca o PIA crescuta acut pana la valori de 10-20 mmHg (HIA mica) are in in general efecte bine compensate si de regula nesemnificative clinic putand fi necesara terapia nonoperatorie. Urmeaza HIA moderata definita de cresterea sustinuta a PIA intre 21-30 mmHg caz in care terapia este in general necesara. Peste aceasta limita urmeaza HIA severa sau SCA ce este definita de o crestere sustinuta a PIA peste 30 mmHg. In aceasta situatie decompresiunea chirurgicala este intotdeauna indicata.
La aceste clasificari s-a ajuns de regula dupa studii efectuate separat si ele vizaza din diferite puncte de vedere valoarea sau impactul HIA. Dezavantajul major este ca ele nu reflecta fidel impactul abdominal/sistemic generat de HIA existent la un moment dat.
Prin similitudine putem compara un pacient la care avem doar o monitorizare a PIA cu un pacient cu sepsis la care avem doar o hemocultura pozitiva. Acesta hemocultura singura nu poate orienta decat antibioterapia in timp ce restul managementului terapeutic necesita evaluarea mult mai complexa a multor parametrii ce redau tot ansamblul disfunctiilor produse de sepsis. Evaluarea pacientului cu sepsis sau MODS care este mult mai studiata pana in acest moment, beneficiaza de multe scale de evaluare (dupa cum vom vedea ulterior) care au ca scop evaluarea gravitatii sau valoare prognostica.
Un alt aspect care trebuie trecut in revista il reprezinta posibilitatea utilizarii scalelor de risc valabile pentru sepsis sau MODS cu atat mai mult cu cat fiziopatologia HIA/SCA se asociaza deseori mai devreme sau mai tarziu cu disfunctie pluriorganica sau sepsis. Sa vedem concret ce utilitate au cele mai utilizate scale de risc folosite in evaluarea pacientului cu sepsis si MODS.
Pentru a intelege mai bine ce valoare au scalele de risc consacrate singure in evaluarea pacientului cu HIA/SCA va supun atentiei un studiu foarte important efectuat de Malbrain si colegii sai cu concluzii foarte interesante. Ei au investigat incidenta hipertensiunii intra-abdominale (HIA) si impactul acesteia asupra pacientilor intr-o populatie mixta de pacienti ATI. Studiul a inclus un numar considerabil de 265 pacienti de la 14 unitati de terapie intensiva din 6 tari pe o perioada de 10 luni. Acestor pacienti le-a fost masurata PIA la admitere si apoi periodic pe parcursul stationarii in terapie intensiva in primele 7 zile. La sfarsitul studiului s-a constatat ca:
-incidenta HIA > 12 mm Hg a fost 32,1%
-dezvoltarea HIA > 12 mm Hg in
timpul sederii UTI a fost un predictor independent de mortalitate ( p =0. 01).
-pacientii cu HIA au avut o mortalitate 38,8%
-pacientii fara HIA au avut o mortalitate 22.2%
Insa o constatare foarte interesanta a fost ca pacientii cu scor APACHE II mic si cu PIA > 12 mmHg, deci nu foarte mare au avut o mortalitate mult mai ridicata decat pacientii cu scor APACHE II similar dar fara HIA. Nu a fost nici o diferenta intre grupurile de pacienti in ceea ce priveste categoriile de diagnostic pentru admitere in terapie intensiva (medicale sau chirurgicale). Cele mai frecvente cauze de HIA cuprinse in studiu au fost: resuscitarea lichidiana cu mai mult de 4,5 l coloide sau cristaloide in primele 24 ore, disfunctie hepatica (ciroza hepatica sau insuficienta cu SCA), ocluzie intestinala (peritonite, tumori abdominale), eventratii si evisceratii inchise in tensiune. Aceste rezultate ofera informatii foarte importante cu privire la HIA care nu au fost luate in discutie pana in acel moment. Cele mai multe cercetari si articole anterioare acestui studiu au avut ca scop importanta evidentierii HIA, a insuficientelor de organ generate de aceasta si delimitarea unui sindrom clinic care cauzeaza o mortalitate ridicata. Insa pana in acest moment SCA nu a fost privit ca un sindrom ce poate surveni pe o insuficienta uni/multiorganica care a fost anterioara aparitiei acestuia si a evoluat in paralel. La aceasta categorie s-a observat ca prognosticul sugerat de marimea HIA nu mai este realist, mortalitatea fiind semnificativ mai mare chiar daca valoarea HIA este doar usor crescuta. Aceasta constatare se observa si in graficul de mai jos care arata ca pentru scoruri APACHE similare pentru toate cele patru zone, mortalitatea a fost aproape de 0 in zonele I si II unde nu a fost prezenta HIA si foarte ridicata (peste 30%) in zonele III si IV unde HIA a fost prezenta. Putem concluziona ca prezenta HIA trebuie considerata ca o "disfunctie de organ" si necesita metode specifice de diagnostic si interventii terapeutice particulare (medicale sau chirurgicale). Cu toate acestea trebuie inteles foarte bine ca tratamentul SCA nu garanteaza un rezultat bun, insa sunt dovezi clare ca imbunatateste semnificativ rezultatele la unii pacienti care altfel ar muri.
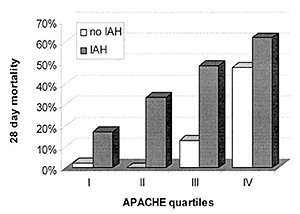
Figura: graficul arata ca pacientii cu scor APACHE scazut fara a fi prezenta HIA au a avut o buna supravietuire comparativ cu pacientii cu APACHE similar si cu HIA la care mortalitatea a fost substantiala.
In lumina constatarilor de mai sus, problema care se pune in acest moment este ce trebuie facut pentru o evaluare mai buna a pacientilor cu HIA/SCA. Studiile efectuate pana acum au avut ca scop evidentierea modificarilor fiziopatologice produse de HIA/SCA pentru a trezi in constiinta lumii medicale existenta acestui fenomen clinic cu consecinte deosebite. Un alt scop bine delimitat al cercetarilor anterioare au vizat gasirea modalitatilor de masurare a PIA. In acest sens s-au gasit mai multe modalitati tehnice si s-a stabilit si o tehnica recomandata prin precizia si usurinta de efectuare - masurarea PIA prin masurarea presiunii intravezicale. Deasemenea a fost foarte bine demonstrat ca masurile terapeutice medicale sau chirurgicale ce vizeaza decompresiunea intraabdominala s-au dovedit foarte eficiente desi nu s-a reusit o protocolizare a managementului terapeutic ci doar s-au schematizat niste principii sau recomandari.
Dupa cum se poate usor observa exista o veriga slaba in monitorizarea si evaluarea pacientilor cu HIA/SCA. Astfel, scala valorilor HIA (I-IV) are mai mult ca scop cuantificarea valorii PIA fara a releva practic o evaluare concreta a gradului afectarii multiorganice iar scorul APACHE reda un grad al afectarii multiorganice dar cu erori mari in ce priveste morbiditatea si mortalitatea pacientilor cu afectiuni preexistente la care se adauga concomitent HIA. Un alt neajuns al scorului APACHE II il constituie faptul ca nu este reproductibil, recomandarea este de a se face in primele 24 ore de la admiterea pacientului in terapie intensiva, ulterior valoarea scorului nu mai are semnificatie. Din acest punct de vedere putem concluziona ca scorul APACHE II nu poate ajuta la evaluarea pacientului cu HIA/SCA decat in primele 24 de ore si nu poate ajuta la evaluarea ulterioara a pacientilor.
O alta importanta concluzie a acestui studiu este ca monitorizarea pacientilor cu HIA/SCA ca parametru unic PIA este o eroare. O evaluare a gravitatii unui pacient cu HIA/SCA care utilizeaza numai acest parametru nu este suficienta deoarece o valoare data a PIA nu poate genera modificari identice la pacienti diferiti, fiecare din acestia dovedindu-se ca au o anumita valoare "PIA critica" la care se produc modificari abdominale si sistemice considerabile si care prezinta o varietate destul de mare. S-a dovedit dealtfel ca exista situatii in care avem valori crescute ale PIA pentru perioade mai mari de timp dar fara consecinte fiziopatologice asupra organismului (obezitate, sarcina) sau daca sunt prezente acestea sunt minore si reversibile (postura, pneumoperitoneul, dializa peritoneala, PEEP-ul utilizat in ventilatia mecanica).
Deasemenea, diferentele de impact sistemic a HIA depind si de durata persistentei hipertensiunii si de afectiunile preexistente ale pacientului, in special cele cronice decompensate sau cu rasunet sistemic. De aici putem concluziona ca utilizarea valorii PIA ca parametru unic este insuficienta pantru a avea o evaluare realista a impactului sistemic al HIA. Totodata trebuie identificati toti parametrii ce pot ajuta la evaluarea pacientului cu HIA si pentru o mai eficienta utilizare a lor includerea acestor parametrii intr-o scala de risc usor de utilizat.
Alte scoruri existente in acest moment, utile in clinicile de terapie intensiva sunt:
Scorul APACHE III a fost publicat in 1991 ca rezultat al unui studiu cea cuprins 17440 de pacienti adulti internati in unitatile de terapie intensiva din 40 de spitale din SUA. Rezultatul calcularii scorului reprezinta o valoare numerica cuprinsa intre 0 si 299. Ramane insa de vazut daca acest scor este confirmat de alte studii ce sunt in desfasurare.
APACHE IV a aparut in 2006 cu scopul de a estima probabilitatea de mortalitate in spitale. Variabilele au fost similare cu cele din APACHE III la care s-au adaugat parametrii noi si au fost folosite interpretari statistice diferite. Prin studii retrospective APACHE IV comparativ cu variantele anterioare a prezis mortalitatea pntru o buna parte din pacientii exclusi.
SAPS II cuantifica 14 parametrii biologici si variabile clinice pentru a dezvolta un sistem simplu de evaluare care sa reflecte riscul de deces la pacientii din terapie intensiva. El se calculeaza in primele 24 de ore de la admiterea in terapie intensiva si reprezinta o metoda mai simpla si mai rapida pentru studii comparative de evaluare.
SOFA (Sequential Organ Failure Assessment) Score reprezinta un scor util in evaluarea incidentei si severitatii disfunctiei de organ la pacientii critici. Studiul a fost prospectiv si a inclus 1449 pacienti internati in 1995 in sectiile de terapie intensiva din 16 tari. Scorul poate fi repetat regulat pe parcursul evolutiei bolii putand ajuta la monitorizarea ei si deasemenea permite comparatie intre pacientii care ar beneficia de studii clinice.
TISS (Therapeutic Intervention Scoring System) evalueaza gravitatea bolii si este bazat pe tipul si cantitatea de tratament primit. Are atat aplicatii clinice cat si administrative ce constau in:
- evaluarea severitatii bolii,
-determinarea resurselor necesare,
-stabilirea facilitatilor de ingrijire folosite
Dictionar - Afisati dictionarul detaliat
Acestea reprezinta scorurile de evaluare a gravitatii pacientului critic din terapie intensiva cu utilitatea si recunoasterea cea mai mare din practica medicala. Majoritatea dintre ele inceaca sa cuantifice gravitatea afectiunii si sa ofere un prognostic cu privire la posibilitatea de deces nu insa si evaluarea ulterioara a pacientilor cu atat mai putin stabilirea eficientei unei interventii terapeutice.
Dintre toate scorurile actuale, cel care poate ajuta
intr-o masura mai mare la evaluarea pacientilor cu HIA/SCA este scorul SOFA. Acest
lucru nu este intamplator intrucat
scorul SOFA (Sequential Organ Failure Assessment
score) este un scor folosit pentru a evalua statusul pacientilor in timpul
stationarii in unitatea de terapie intensiva si are scopul de a cuantifica
gradul insuficientei multiorganice. Scorul este bazat pe 6 scoruri diferite,
cate unul pentru fiecare sistem: respirator, cardiovascular, hepatic,
coagulare, renal si neurologic.
Sistemul SOFA a fost creat
intr-o sedinta de consens a Societatii Europene de Terapie Intensiva in 1994 si revizuit in 1996. SOFA cuantifica
6 posibile disfunctii de organ. In functie de gradul afectarii functiei pentru
fiecare organ, se acorda un punctaj de la 0 (functie normala) la 4 (functie
sever alterata), obtinandu-se un scor de la 0 la 24 de puncte. Obiectivul
crearii scorului SOFA a fost acela de a crea un scor simplu, fiabil, usor de
efectuat in orice institutie si, foarte important, cu posibilitatea de a fi
reefectuat oricand pe parcursul internarii, mentinandu-si valoarea de indicator
prognostic atat in primele zile de la admitere cat si pe parcursul internarii.
Insa si scorul SOFA are neajunsul privind monitorizarea pacientilor cu HIA/SCA deoarece nu are nici o tangenta cu valoarea si implicatiile prezentei HIA ci numai cu consecintele acesteia. Astfel scorul SOFA poate fi folosit pentru monitorizarea si cuantificarea disfunctiei multiorganice a pacientilor cu HIA/SCA, dar din momentul in care pacientul ajunge la stadiul de MODS cand deja s-au pierdut primele faze in care se putea diagnostica HIA prin intermediul unor alti parametrii (PIA, PPA) neinclusi in SOFA.
In urma celor prezentate putem concluziona ca nici un scor de evaluare a pacientilor gravi utilizat in unitatile de terapie intensiva nu este adecvat pentru monitorizarea pacientilor cu HIA/SCA din considerentele prezentate mai sus. Deasemenea nici clasificarile HIA si gradele de gravitate a PIA luate singular nu pot reda constelatia de modificari sistemice produse. Din aceste doua considerente a aparut ideea crearii unei scale de risc proprii pentru HIA/SCA care sa adune benefiile cumulatede monitorizarea PIA si a unor parametrii specifici disfunctiilor de organ ce apar frecvent in acest sindrom.
1.3. Variabile ce urmeaza a fi investigate.
Dupa cum am mai subliniat, cresterea presiunii intra-abdominale (PIA) este intalnita in mod frecvent la pacientii critici si se asociaza cu o morbiditate si mortalitate semnificativa. Masurarea IAP, cel mai adesea prin masurarea surogat a presiunii intravezicale, a fost identificata ca esentiala pentru diagnosticul si tratamentul corect al pacientilor cu IAH sau ACS. Insa "PIA critica' ce produce disfunctii de organ difera de la pacient la pacient in functie de fiziologia si comorbiditatile preexistente ale fiecaruia. Prin urmare, o singura valoare-prag a IAP nu poate fi folosita pentru luarea deciziilor clinice la toti pacientii critici.
Acest lucru este dovedit si de evolutia in timp a valorii prag stabilite. Astfel primele studii au sugerat ca o IAP de 30 pana la 40 mm Hg ar fi acceptabila, iar acum se recunoaste ca si cresteri mici ale IAP la 10-15 mmHg pot sa aiba un impact enorm asupra perfuziei organelor si asupra prognosticului pacientului. Prin urmare, definitia IAH a necesitat o ajustare continua de-a lungul anilor, iar valoarea 'IAP critice' care necesita interventia terapeutica a fost micsorata. De asemenea au fost extinse categoriile de pacienti cu risc pentru IAH si ACS. Considerate initial ca apar la pacientii cu traumatisme, acum se stie ca IAH si ACS apar practic la toate categoriile de pacienti cu o incidenta mai mare sau mai mica. Totodata s-a constat ca rapiditatea instalarii si prezenta comorbiditatilor au un impact semnificativ asupra prezentarii clinice si managementului IAP crescute. Varsta, obezitatea, sarcina, mecanismul injuriei, difunctia sau insuficienta pulmonara, cardiaca sau renala, necesitatea ventilatiei mecanice si aparitia SIRS, au fost recunoscute ca factori ce influenteaza evolutia si tratamentul acestor bolnavi critici.
Desi gasirea 'IAP critica' ce necesita interventia terapeutica a fost considerata 'graalul' cercetarii IAH si ACS, cercetarile si experienta acumulata arata ca o astfel de abordare simplifica prea mult un proces fiziologic care de fapt este foarte complex si variabil. Desi IAP este un factor determinant major al prognosticului pacientului critic, IAP care defineste IAH si ACS in mod evident difera de la pacient la pacient si chiar in cazul aceluiasi pacient, in functie de evolutia bolii. In intervalele acceptabile clinic, IAP poate fi un predictor specific, dar insensibil al severitatii bolii si al caracterului adecvat al resuscitarii. Cresterea sensibilitatii diagnostice a IAP ar necesita ca pacientii sa fie lasati sa aiba valori ale IAP mai mari. Dar se stie ca astfel de valori ale IAH produc tulburari de perfuzie organica, si o astfel de practica ar fi inacceptabila clinic, avand in vedere nivelul actual de intelegere a morbiditatii si mortalitatii IAH. Astfel, cu toate ca este o metoda utila de screening, IAP nu are o sensibilitate suficienta pentru a fi folosita ca enpoint al resuscitarii. Tinand cont de variabilitatea marcata a valorilor IAP la pacientii critici, este putin probabil ca se putea folosi vreodata o singura valoare-prag la toti pacientii critici.
Din aceste considerente consider ca evaluarea consecintelor fiziopatologice in ansamblu induse de prezenta HIA si evaluarea evolutiei pacientului implica monitorizarea mai multor parametrii clinici si paraclinici, eventual constituiti intr-un scor pe care il voi denumi ,,scorul SCA".
Alegerea initiala a acestor parametrii a fost facuta din cadrul celor care au sensibilitatea si specificitatea cea mai mare in disfunctiile organelor sausistemelor afectate de HIA/SCA. Ramane de vazut in urma obtinerii rezultatelor cercetarii, gradul modificarii sau ponderea pe care acesti parametrii o au in redarea cat mai exacta a starii pacientului cu HIA/SCA. Un alt criteriu foarte important pentru alegerea parametrilor constituienti ai scorului SCA a fost ca acesti parametrii sa fie uzual sau macar usor masurabili ori de cate ori este nevoie, sa nu necesite dotari de varf sau cunostinte specifice doar unei specialitati. Am urmarit in acest sens ca scorul SCA sa fie usor de calculat de orice medic din specialitatile in care HIA/SCA este intalnita. Totodata nu trebuie trasa concluzia ca in acest fel s-ar obtine o evaluare incompleta sau nu tocmai performanta a starii pacientului intrucat criteriile ramase consider ca reflecta in aceeasi masura starea pacientului. In acest sens fac trimitere la unele din cele mai cunoscute si raspandite scoruri din TI: APACHE si SOFA, utilizate in majoritatea studiilor clinice ce vizeaza pacientii Ddin terapie intensiva. Acestea includ parametrii clinici si paraclinici uzuali ca de altfel si scorul SCA pe care incerc sa-l conturez.
In primul rand sa trecem foarte pe scurt organele si sistemele afectate de HIA/SCA si parametrii cei mai fideli ce reflecta afectarea lor.
Modificari clinice si paraclinice ale sistemului respirator sunt
-reducerea volumului toracic
-cresterea presiunii intratoracice avand consecinta aparitie atelectaziei alveolare, scaderea difuziunii oxigenului si a bioxidului de carbon, cresterea suntului si a spatiului mort alveolar
-scade complianta pulmonara statica si dinamica
In concluzie putem alege parametrii adecvati pentru evaluarea disfunctiei ventilatorii pe aceia care arata nivelul hipoxemiei, hipercarbiei si a eventualei acidize respiratorii: PaO2, PaCO2, raportul PaO2/PaCO2, frecventa respiratorie si pH-ul.
Efectele hemodinamice determinate de cresterea PIA asupra sistemului cardio-vascular sunt:
-scade intoarcerea venoasa
-creste presiunea in artera pulmonara si PVC
-scade debitul cardiac
-creste rezistenta vasculara periferica
-scade TAM tardiv sau in caz de hipovolemie
-scaderea indexului volumului end-diastolic al ventriculului drept (right ventricular end-diastolic volume index -RVEDVI) si/sau indexului volumului end-distolic global (global end-diastolic volume index -GEDVI)
Parametrii cei mai fideli, dealtfel foarte importanti in aprecierea resuscitarii lichidiene a pacientior sunt RVEDVI si GEDVI. Din pacate monitorizarea lor nu poate fi facuta de rutina astfel ca isi pierd utilitatea in favoarea PVC. Insa si PVC are neajunsul ei deoarece valoarea masurata este fals crescuta din cauza cresterii presiunii intratoracice. Consecinta este ca resuscitarea lichidiana efectuata luand in considerare doar valoarea PVC duce la o resuscitare fluida inadecvata urmata de persistenta globala a ischemiei organelor si cresterea riscului de MODS si deces. Pentru a evita acest neajuns PVC trebuie corectata astfel:
PVC corectata = PVC masurata - PIA/2
Aceasta recomandare este facuta si de WSACS conform unor studii multicentrice.
In consecinta vom masura pentru monitorizarea functiei cardiac: PVCc, TAM si frecventa cardiac.
Efectele HIA asupra sistemului nervos central sunt foarte frecvente cu atat mai mult la pacientii ce au o concomitenta de trauma abdominal s cerebrala:
-reducerea perfuziei cerebrale- PPC
-cresterea presiunii intracraniene- PIC
-edem cerebtal, anoxia creierului, alterarea starii de constienta, coma.
Idealul monitorizarii afectarii afectarii cerebrale ar fi masurarea PIC, insa dificultatea efectuarii acestei masuratori face improbabila includerea ei intr-un scor cu aplicabilitate larga. Din acest considerent ma voi rezuma ca si in scorurile APACHE si SOFA la evaluarea starii neurologice cu ajutorul scorului Glasgow.
Modificarile fiziopatologice determinate de cresterea PIA la nivelul aparatului digestive sunt:
-scade fluxul sanguine pentru toate organele intraabdominale si retroperitoneale, cele mai importante implicatii avandu-le hipoperfuzia hepatica si intestinala
-cresterea pH-ului intramucosal gastic/intestinal
-afectarea metabolismelor in care este implicat ficatul
-acidoza metabolic datorata hipoperfuziei intestinale
-aparitia sangerarilor si translocarii bacteriene prin deteriorarea ischemica a mucoasei intestinale
Este dificil gasirea unor parametrii clinici sau paraclinici care sa reflecte modificarile produse de HIA asupra tubului digestiv din mai multe considerente: monitorizarea PH-ului gastric sau intestinal nu se efectueaza de rutina (tonometrul nu intra in dotarile standard ale unitatilor de terapie intensiva), iar perturbarile metabolice, aparitie sangerarilor si translocarea bacteriana nu sunt constante in tabloul clinic al SCA ci reprezinta mai degraba ,,complicatii", esecul terapeutic sau neidentificarea precoce a acestui sindrom.
Cu toate acestea din cercetari anterioare se contureaza doi parametrii utili pentru reflectarea amplorii modificarilor intraabdominale si anume presiunea intraabdominala PIA si presiunea de perfuzie abdominala PPA. PIA a fost considerata ca fiind parametrul central al monitorizarii HIA/SCA. Masurarea
ei se poate face dupa o minima pregatire chiar si de un cadru medical cu o pregatire medie printr-o tehnica care poate fi de la simpla (utilizarea unui sistem de tuburi si manometru), pana la un sistem dedicat - dispozitiv AbViser + monitor sau dispozitiv de senzor + monitor pentru masurarea PVC care se gasesc de rutina in sectiile de terapie intensiva. Pe de alta parte PPA reprezinta un parametru care castiga din ce in ce mai multa importanta asa cum arata cateva studii de mai mica amploare. Acestea sustin chiar ca ar avea o sensibilitate si o specificitate mai mare decat PIA pentru gradul afectarii multiorganice. PPA este definita matematic de diferenta dintre tensiunea arteriala medie TAM si PIA. aceasta superioritate valorica ar avea ca fundament faptul ca PIA critica prezinta variatii individuale destul de mari, iar PPA reflecta mai intim gradul perfuzarii organelor intraabdominale. Ramane de vazut in cursul acestui studiu care din cei doi parametri este mai sensibil si mai specific pentr HIA/SCA.
Efectele renale produse de prezenta HIA/SCA sunt:
-scaderea fluxului arterial si venos renal
-compresiune, congestie si edem renal
-scaderea RFG
-necroza tubulara acuta
-oligurie/anurie neresponsive la repletia volemica sau imbunatatirea functiei cardiace
-IRA
Pentru evidentierea acestor modificari consider ca parametrii cei mai adecvati sunt prezenta/absenta oliguriei/anuriei si cresterea creatininei ca marker al IRA. Un alt parametru ar putea fi presiune de perfuzie renala gradientul de filtrare glomerulara utilizat larg in cercetari pentru evidentierea precoce a insuficientei renale. FG este egala cu diferenta dintre presiunea de filtrare glomerulara (PFG) si presiunea din tubul proximal (PTP).
FG = GFP - PTP
Insa in prezenta HIA se poate admite ca PTP este egala cu PIA si PFG se calculeaza ca PAM - PIA. In consecinta FG se calculeaza dupa formula:
FG = PAM - 2xPIA
Desi acest parametru ar fi arata mult mai precoce aparitia IRA comparativ cu
Oliguria care poate fi considerata o consecinta, dificultatea masurarii FG directe fara a face uz de aceste aproximari o trec pe locul secund.
In concluzie, parametrii finali ce vor fi inclusi in scorul SCA si monitorizati sunt:
-PaO2
-PaCO2
-frecventa respiratorie
-pH-ul.
-PVCc
-TAM
-Scorul Glasgow
-PIA
-PPA
-oliguria/anuria
-creatinina
Pentru inceput vom lua in considerare toti acesti parametrii urmand ca ulterior, in functie de sensibilitatea si specificitatea pe care acestea o vor obtine pentru predictia si evaluarea HIA/SCA, sa ii alegem pe cei mai valorosi ca informatie si sa constituim scorul SCA.
? ? ??????????ceva de finish
1.4 Reprezentarile grafice ale cadrului conceptual sau ale teoriei sunt utile sustinerii proiectului.
2. Material si metoda
2.1. Planul de cercetare, etape, strategii, formularea si verificarea ipotezelor, rezultate deductibile
2.2. Metode si echipemente de lucru
2.3. Locul de desfasurare al studiului
2.4. Lotul, esantionare, cum este reprezentativ, populatia tinta Criterii de selectie, inincludere, excludere
2.5. Parametrii cercetati
2.6. Fisa de monitorizare
2.7. Modalitati de analiza a datelor
2.8. Parametrii cercetati
2.8.1. PPA
2.8.1.1. Definitie.
2.8.1.2. Modalitati de masurare.
2.8.1.3. Colectarea datelor.
2.8.1.4. Rezultate.
2.8.1.5. Analiza statistica a datelor.
2.8.1.6. Interpretatea rezultatelor.
2.8.2. PIA.
2.8.2.1. Definitie.
2.8.2.2. Modalitati de masurare.
2.8.2.3. Colectarea datelor.
2.8.2.4. Rezultate.
2.8.2.5. Analiza statistica a datelor.
2.8.2.6. Interpretatea rezultatelor.
2.8.3. PaO2
2.8.3.1. Definitie.
2.8.3.2. Modalitati de masurare.
2.8.3.3. Colectarea datelor.
2.8.3.4. Rezultate.
2.8.3.5. Analiza statistica a datelor.
2.8.3.6. Interpretatea rezultatelor.
2.8.4. PaCO2
2.8.4.1. Definitie.
2.8.4.2. Modalitati de masurare.
2.8.4.3. Colectarea datelor.
2.8.4.4. Rezultate.
2.8.4.5. Analiza statistica a datelor.
2.8.4.6. Interpretatea rezultatelor.
2.8.5. Frecventa respiratorie
2.8.5.1. Definitie.
2.8.5.2. Modalitati de masurare.
2.8.5.3. Colectarea datelor.
2.8.5.4. Rezultate.
2.8.5.5. Analiza statistica a datelor.
2.8.5.6. Interpretatea rezultatelor.
2.8.6. pH-ul
2.8.6.1. Definitie.
2.8.6.2. Modalitati de masurare.
2.8.6.3. Colectarea datelor.
2.8.6.4. Rezultate.
2.8.6.5. Analiza statistica a datelor.
2.8.6.6. Interpretatea rezultatelor.
2.8.7. PVC c
2.8.7.1. Definitie.
2.8.7.2. Modalitati de masurare.
2.8.7.3. Colectarea datelor.
2.8.7.4. Rezultate.
2.8.7.5. Analiza statistica a datelor.
2.8.7.6. Interpretatea rezultatelor.
2.8.8. TAM
2.8.8.1. Definitie.
2.8.8.2. Modalitati de masurare.
2.8.8.3. Colectarea datelor.
2.8.8.4. Rezultate.
2.8.8.5. Analiza statistica a datelor.
2.8.8.6. Interpretatea rezultatelor.
2.8.9. Scorul Glasgow
2.8.10.1. Definitie.
2.8.10.2. Modalitati de masurare.
2.8.10.3. Colectarea datelor.
2.8.10.4. Rezultate.
2.8.10.5. Analiza statistica a datelor.
2.8.10.6. Interpretatea rezultatelor.
2.8.10. Diureza
2.8.11.1. Definitie.
2.8.11.2. Modalitati de masurare.
2.8.11.3. Colectarea datelor.
2.8.11.4. Rezultate.
2.8.11.5. Analiza statistica a datelor.
2.8.11.6. Interpretatea rezultatelor.
2.8.11. Creatinina
2.8.12.1. Definitie.
2.8.12.2. Modalitati de masurare.
2.8.12.3. Colectarea datelor.
2.8.12.4. Rezultate.
2.8.12.5. Analiza statistica a datelor.
2.8.12.6. Interpretatea rezultatelor.
9. Interpretarea rezultatelor.
10. Stabilirea structurii scorului.
11. Discutii.
12. Anexe.
2. Material si metoda
2.1. Planul de cercetare, etape, strategii, formularea si verificarea ipotezelor, rezultate deductibile
2.2. Metode si echipemente de lucru
2.3. Locul de desfasurare al studiului
2.4. Lotul, esantionare, cum este reprezentativ, populatia tinta .Criterii de selectie, inincludere, excludere
1- PREVALENTA SI INCIDENTA PIA/HIA --àALEGEREA LOTULUI DE PAC (INCLUSI)
2- LA ALEGEREA PAC S-A RESPECTAT PROPORTIA INCIDENTEI HIA/SCA IN PLAJA DE PAC CU HIA/SCA
2.5. Parametrii cercetati
2.6. Fisa de monitorizare
2.7. Modalitati de analiza a datelor
Am efectuat analiza statistica cu ajutorul curbei Roc, aceasta prezentand Mai multe advantage si caracteristici:
-face raportul rezultatelor adevarat pozitive fat a de cele fals pozitive rezultand un grafic al sensibilitatii testului
-are o buna putere discriminatorie si evalueaza toate valorile rag posibile
-poate prege prezice supravietuirea cu o probabilitate foarte mare avand o arie de sub curba Roc de 1 fata de un test care poate prezice supravietuirea numai aleator si are aceasta suprafata nu mai mare de 0,5.
-a fost utilizat datorita avantajelor lui si in alte studii ce au vizat PIA sau PPA ca parametrii de predictie
g
Considerente statistice Curbele ROC descrie grafic sensibilitatea unui test diagnostic (proportie adevarate pozitive) fata de 1 specificitatea minus (proportia fals pozitiv) si sa ofere o masura buna de putere discriminatorii de ansamblu a unui test ca le evalueaza toate valorile posibile prag. Un test care prezice intotdeauna supravietuire are o suprafata de sub curba ROC de 1,0 si un test care prezice supravietuirea nu mai des decat de noroc are o suprafata de 0,5. Punctul de pe curba de cel mai apropiat ROC la coltul din stanga sus este in general considerata a optimiza sensibilitatea si specificitatea testului. Atunci cand a evaluat utilizarea IAP sau APP ca parametru de predictie in studiile epidemiologice, avantajele analizei ROC in timpul interpretarii de studiu ar trebui sa fie luate in considerare. Prin urmare, evaluarea pragurilor IAP si APP trebuie sa se bazeze pe o analiza a caracteristicilor de exploatare receptor (ROC) si aria de sub curba ROC-. Relevanta Regresiei Logistice Multinple
|
http://www.licalafat.ro/documente/Curs%20Nr.%2014%20Regresia%20liniara.ppt
2.8. Parametrii cercetati
2.8.1. PIA
2.8.1.1. Definitie.
Abdomenul contine mai multe organe solide (ficatul, rinichii, splina, etc) si fluide (sange, urina, continut intestinal) cu complianta limitata, dar si organe cavitare care contin aer (stomacul, intestinul subtire, colonul) cu distensibilitate marcata, si spatii potentiale (peritoneul, retroperitoneul) care pot sa se mareasca semnificativ ca raspuns la o leziune sau boala. Abdomenul poate sa contina si procese patologice inlocuitoare de spatiu, cum ar fi sange, aer, ascita, sau o tumora. La fel ca in creier si conform cu doctrina Monro-Kellie, o crestere a volumului continutului cavitatii abdominale va duce la o crestere a IAP. Desi nu este inchis intr-un invelis rigid cum este creierul, abdomenul nu este nici pe departe perfect compliant si expansibil. Unele parti din abdomen, cum ar fi coloana vertebrala, pelvisul si arcurile costale sunt rigide, in timp ce altele, ca diafragmul si in special peretele abdominal, sunt compliante numai pana la un punct determinat de diversi factori.
Varsta, obezitatea, musculatura peretelui abdominal, sarcina si chirurgia abdominala pot sa altereze complianta peretelui abdominal. Durerea si edemul spatiului 3 de asemenea reduc complianta si maresc efectele negative ale IAP crescute. Toti acesti factori pot sa aiba un impact semnificativ asupra capacitatii pacientului de a tolera IAH, ca si asupra adecvabilitatii perfuziei abdominale.
Din definitiile elaborate de WSACS le reamintesc pe acelea care prezinta o importanta deosebita ȋn monitorizarea PIA/HIA/SCA:
1- HIA este definita ca o valoare de varf a PIA > 12 mmHg, ȋnregistrata la cel putin doua masuratori standardizate efectuate la 4-6 ore interval sau o PPA <50 mmHg;
2- HIA si SCA reprezinta etape ale aceluiasi proces patologic;
3- SCA este definita ca o valoare de varf a PIA > 20 mmHg si sau PPA < 50 mmHg ȋnregistrate la minim doua masuratori standardizate la un interval de 2-6 ore la care se asociaza una sau mai multe insuficiente de organ;
2.8.1.2. Modalitati de masurare.
PIA este presiunea de echilibru existenta in cavitatea abdominala. PIA variaza cu respiratia, elasticitatea peretelui abdominal si greutatea specifica a continutului abdominal, factori ce ar putea determina la un moment dat o presiune ȋntr-o anumita pozitie.
Deoarece abdomenul si continutul sau poate fi considerat ca fiind relativ necompresiv si avand ȋn primul rand caracter fluid, ȋn conformitate cu legea lui Pascal, PIA poate fi masurata ȋn aproape fiecare parte din abdomen. De aici si aparitia diferitelor metode de masurare a PIA: transvezical, transgastric si direct prin punctie abdominala (si alte cateva variante de masurare experimentale).
PIA trebuie sa fie masurata doar la un pacient aflat ȋn pozitia de decubit dorsal complet, cu musculatura abdominala relaxata, foarte cooperant sau ȋn cazul pacientilor agitati este utila sedarea pana la un echivalent de Scor Richmond egal cu -4.
Primul standard de aur al masurarii PIA a fost considerat masurarea directa prin punctionarea abdomenului cu ajutorul acului Verres. Imediat ȋnsa au aparut cateva inconveniente si anume posibilitatea blocarii sau ȋnfundarii acului, riscul de perforatii intestinale, dificultatea efectuarii repetate a manevrei si obiectia ca o masurare invaziva nu poate fi considerata ca un standard de aur. Astfel masurarea directa a cedat locul masurarii PIA pe cale transvezicala, aceasta fiind considerata ȋn acest moment standardul de aur al masurarii PIA. Tehnica masurarii PIA pe cale transvezicala cuprinde urmatoarele etape.
1- montarea unui cateter vezical - sonda uretrala Foley cu doua sau trei cai de dimensiuni cuprinse ȋntre 12-24 Fr ȋn functie de anatomia pacientului si golirea continutului vezical;
2- conectarea la iesirea sondei uretralea a transductorului
3- calibrarea monitorului la 0 dupa pozitionarea la nivel medioaxilar a transductorului
4- pensarea tubului pungii colectoare urinare si introducerea unei cantitati de 20-25 ml ser fiziologic la temperatura camerei ȋn vezica urinara prin intermediul unei seringi adaptata la portul specific
5- citirea valorii PIA pe monitor, dupa o perioada de echilibrare de minim 30-60 sec, o valoare exprimata ȋn mmHg sau cmH2O (factorul de conversie de la mmHg la cmH2O este de 1,36 si invers de 0,74); deasemenea citirea trebuie facuta la sfarsitul expirului sau la pacientii ventilati mecanic, dupa decuplarea acestora de la aparatul de ventilatie mecanica (manevra similara masurarii presiunii venoase centrale PVC).
Studii clinice
In 2000, Cheatham et al au propus pentru prima data folosirea APP ca factor predictiv al supravietuirii la pacientii cu IAH sau ACS. A fost facut un studiu retrospectiv care a evaluat toti pacientii admisi intr-o unitate de terapie intensiva cu profil chirurgical / traumatologic, care prezentau semne ale IAH (definita ca IAP ≥ 15 mmHg). S-a instituit monitorizarea IAP atunci cand au fost prezente unul sau mai multe semne ale disfunctiei organice induse de IAH, aici fiind incluse distensia abdominala, oliguria refractara la resuscitarea volemica, hipercarbia, hipoxemia refractara la cresterea FiO2 si a PEEP, presiuni inspiratorii de varf mari, sau hipotensiunea refractara. Monitorizarea IAP a fost instituita si in absenta acestor semne daca clinicianul banuia prezenta unei IAP crescute. A fost masurata presiunea intravezicala din 4 in 4 ore folosind tehnica descrisa de Cheatham and Safcsak, pana cand IAP s-a normalizat sau masuratorile au fost constante si nu s-a mai considerat ca pacientul risca sa faca disfunctie organica din cauza IAH. S-au urmarit endpointurile obisnuite ale resuscitarii: pH-ul, deficitul de baze, lactatul arterial, si diureza orara. Decompresiunea abdominala deschisa si inchiderea temporara a abdomenului au fost facute in cazul IAH simptomatice sau aparitiei ACS (definit ca IAP ≥ 25 mmHg insotita de unul sau mai multe semne de insuficienta organica indusa de IAH). Analiza regresiei logistice multivariate a identificat acele variabile fiziologice si endpointuri ale resuscitarii care se coreleaza in mod semnificativ cu supravietuirea.
In cele 25 de luni cat a durat studiul, la 144 de pacienti (68% pacienti cu traumatisme, 14% de chirurgie generala, 14% chirurgie vasculara, 2% chirurgie colorectala, si 2% de obstetrica-ginecologie) le-au fost facute 2298 de masurari ale IAP in timpul tratamentului IAH si ACS. IAP medie pentru toti pacientii a fost de 22 ± 8 mm Hg (interval 2-94), in ciuda aplicarii liberale a decompresiunii abdominale. Pacientilor li s-a monitorizat IAP in medie 2-3 zile (interval 1-11 zile), timp in care s-au facut 16 ± 14 masuratori (interval 1-61). Mortalitatea totala a fost de 53%. Un numar semnificativ mai mic de pacienti au facut ACS in a doua jumatate a studiului (64% fata de 43%; p = 0.01) si mortalitatea a scazut semnificativ (44% fata de 28%; p = 0.049) ca rezultat al educarii medicilor si al cresterii acceptabilitatii decompresiunii abdominale.
2.8.1.3. Rezultate.
Analiza regresiei logistice multivariate a demonstrat ca IAP, MAP, APP, lactatul arterial, pH-ul arterial, deficitul de baze si debitul urinar pe ora influenteaza supravietuirea pacientilor cu IAH, iar debitul urinar pe ora si APP au valoarea predictiva cea mai mare (Tabelul 2).
Tabelul 2. Parametrii resuscitarii in IAH/ACS aranjati dupa supravietuire
|
|
Supravietuitori |
Decese |
Relevanta Regresiei Logistice Multiple |
|
Debitul urinar pe ora (ml/h) |
113 ± 112 |
79 ± 111 |
< 0.0001 |
|
APP (mm Hg) |
69 ± 17 |
61 ± 18 |
0.0001 |
|
Acidul lactic arterial L (mmol/L) |
2.9 ± 1.5 |
4.5 ± 2.5 |
0.0002 |
|
MAP (mm Hg) |
88 ± 15 |
85 ± 15 |
0.0004 |
|
pH-ul arterial |
7.34 ± 0.08 |
7.27 ± 0.10 |
0.03 |
|
Deficitul de baze |
3.6 ± 4.8 |
7.5 ± 5.6 |
0.04 |
|
IAP (mm Hg) |
20 ± 6 |
24 ± 8 |
0.05 |
MAP: tensionea arteriala medie; IAP: presiunea intra-abdominala; APP: presiunea de perfuzie abdominala
O analiza care a folosit valorile cele mai rele ale parametrilor masurati in timpul resuscitarii a gasit ca valoarea cea mai mica a APP este semnificativ mai buna fata de alti parametri pentru stabilirea prognosticului pacientului cu IAH (Tabelul 3).
Au fost calculate curbele ROC (Receiver operator characteristic, curba caracteristica performantei unui test) pentru IAP si APP pentru a identifica acele valori prag ale fiecarui parametru - care au valoarea predictiva cea mai mare pentru prognostic. Curba ROC consta in reprezentarea pe un grafic a sensibilitatii unui test diagnostic (procentul de rezultate real pozitive) pe abscisa, fata de 1-specificitate (procentul de rezultate fals pozitive) pe ordonata - si este apreciaza bine valoarea discriminatorie a unui test, deoarece curbele ROC iau in consideratie toate valorile prag posibile. Un test diagnostic cu valoare predictiva de 100% are suprafata de sub curba ROC egala cu 1,0 , iar un test care prezice supravietuirea din intamplare are suprafata de sub curba ROC egala cu 0,5. Se considera ca punctul de pe curba ROC situat cel mai aproape de coltul din stanga-sus optimizeaza sensibilita tea si specificitatea testului.
In acest studiu, aria de sub curba ROC a fost 0.726 pentru APP si 0.748 pentru IAP (Figura 1; IAP a fost trasata in functie de mortalitate si nu fata de supravietuire cum era in studiul original).
Figura 1. Curbele ROC pentru IAP si APP si punctele importante pentru luarea deciziilor clinice.
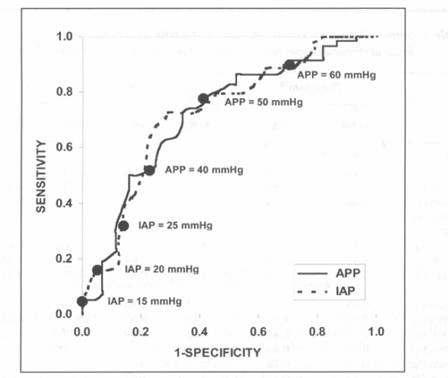
Desii ariile de sub curbele ROC pentru APP si IAP nu sunt diferite statistic, aceste curbe demonstreaza ca sensibilitatea si specificitatea APP sunt superioare fata de IAP pentru luarea deciziilor clinice. (Tabelul 4).
Tabelul 4. Sensibilitatea si specificitatea APP, MAP si IAP pentru prognosticul supravietuirii la pacienti cu hipertensiune intraabdominala si sindrom de compartiment abdominal.
|
|
Cheatham |
Malbrain |
CIAH |
|||
|
|
SENS |
SPEC |
SENS |
SPEC |
SENS |
SPEC |
|
APP |
|
|
|
|
|
|
|
40 mm Hg |
0.53 |
0.78 |
0 .14 |
0.98 |
0.14 |
0.95 |
|
50 mm Hg |
0.76 |
0.55 |
0.39 |
0.91 |
0.53 |
0.85 |
|
60 mm Hg |
0.92 |
0.25 |
0.55 |
0.76 |
0.79 |
0.62 |
|
70 mm Hg |
0.97 |
0.18 |
|
|
|
|
|
MAP |
|
|
|
|
|
|
|
60 mm Hg |
0.23 |
0.87 |
0.34 |
0.87 |
0.40 |
0.87 |
|
70 mm Hg |
0.57 |
0.60 |
0.58 |
0.64 |
0.69 |
0.61 |
|
80 mm Hg |
0.83 |
0.21 |
0.74 |
0.42 |
0.85 |
0.41 |
|
IAP |
|
|
|
|
|
|
|
12 mm Hg |
0.05 |
1.0 |
0.44 |
0.93 |
0.75 |
0.59 |
|
15 mm Hg |
0.05 |
1.0 |
0.23 |
0.97 |
0.47 |
0.75 |
|
20 mm Hg |
0.16 |
0.85 |
0.06 |
0.99 |
0.17 |
0.92 |
|
25 mm Hg |
0.32 |
0.86 |
|
|
|
|
|
30 mm Hg |
0.70 |
0.72 |
|
|
|
|
|
35 mm Hg |
0.80 |
0.47 |
|
|
|
|
|
40 mm Hg |
0.89 |
0.32 |
|
|
|
|
Mentinerea unei APP de cel putin 50 mmHg pare sa maximizeze sensibilitatea (76%) si specificitatea (57%) APP ca predictor al supravietuirii. MAP de 70 mmHg, utilizata de obicei ca parametru al resuscitarii are o sensibilitate de numai 57% si o specificitate de 61%. Desi o valoare a IAP de 30 mm Hg are o sensibilitate de 70% si o specificitate de 72%, acest endpoint depaseste valorile care sunt considerate acum acceptabile clinic, si ar supune pacientul unui risc de perfuzie organica insuficienta. In intervalul acceptat actual de 10 pana la 25 mm Hg, IAP a avut specificitate, dar nu si sensibilitate pentru stabilirea prognosticului. APP pare sa fie superior clinic ca endpoint al resuscitarii si predictor al supravietuirii in tratamentul IAH si ACS, deoarece ea are legatura nu numai cu severitatea IAH, dar si cu caracterul adecvat al perfuziei organelor.
Pentru a evalua validitatea clinica a diferitilor parametri ai resuscitarii la pacientii cu IAH, inclusiv a APP, Malbrain et al au evaluat prospectiv 8 pacienti tratati de catre chirurgi cu un corset abdominal pentru a reduce dehiscenta postoperatorie si hernia incizionala. S-a observat ca IAP creste semnificativ dupa aplicarea braului abdominal, cu scaderi semnificative ale debitului cardiac si cresteri ale presiunii venoase centrale si a presiunii de ocluzie a arterei pulmonare dupa 30-45 de minute. Odata cu cresterea IAP perfuzia viscerala s-a inrautatit, fapt indicat de scaderea APP, FG, a pH-ului arterial, a pH-ului intramucos (pHi) si a diferentei dintre PCO2 arterial si gastric (CO2-gap). Adaugarea unui PEEP de 15 cm H2O combinat cu IAP crescuta are un si mai mare efect negativ asupra APP si a perfuziei viscerale. Aceste efecte au fost reversibile la desfacerea corsetului abdominal (simuland decompresiunea abdominala) si la scaderea PEEP. Acest studiu a confirmat impactul negativ semnificativ al IAP crescute si al presiunii intratoracice asupra APP si a perfuziei viscerale. Decompresiunea abdominala a marit APP li a scazut IAP, restabilind perfuzia abdominala. S-a observat ca markerii regionali ai perfuziei adecvate cum ar fi APP, FG, pHi si CO2-gap se modifica mai repede decat indicii generali ca MAP, pH-ul arterial, deficitul de baze si bicarbonatul calculat (HCO3), ceea ce sugereaza ca markerii regionali sunt superiori ca si parametri ai resuscitarii.
Ulterior Malbrain et al au studiat prospectiv aparitia IAH la 405 pacienti internati intr-o unitate de TI mixta, intr-o perioada de 12 luni. IAP a fost evaluata de rutina la toti pacientii si au fost notate valorarea IAP maxime si valoarea cea mai mica a APP din primele 72 de ore. IAH (definita ca IAP>12 mm Hg) a fost asociata cu o valori semnificativ mai mari ale mortalitatii in Terapie Intensiva (65% vs. 8%; p<0.0001) si ale mortalitatii intraspitalicesti (69% vs. 18%; p<0.0001). APP a fost semnificativ mai mica la cei care nu au supravietuit (61 ± 23 vs. 76 ± 23 mm Hg; p<0.0001), la fel a fost si MAP (72 ± 22 vs. 83 ±22 mm Hg; p<0.0001), in timp ce IAP a fost semnificativ mai mare (11± 5 vs. 7±4 mm Hg; p<0.0001). S-a constatat ca o APP de 60 mm Hg are o sensibilitate de 55% si o specificitate de 76% pentru prezicerea supravietuirii, iar o MAP de 70 mm Hg are o sensibilitate de 58% si o specificitate de 64% (Tabelul 4).
Tabelul 3. Parametri care influenteaza prognosticul in IAH/ACS aranjati in functie de supravietuire.
|
|
Survivors |
Non-Survivors |
Significance of Multiple Logistic Regression |
|
Lowest APP (mm Hg) |
52 ± 17 |
39 ± 18 |
0.002 |
|
Lowest MAP (mm Hg) |
74 ± 14 |
69 ± 14 |
0.05 |
|
Highest IAP (mm Hg) |
29 ± 12 |
38 ± 14 |
0.21 |
|
Highest arterial lactate (mmol/L) |
5.4 ± 2.2 |
8.0 ± 3.7 |
0.38 |
|
Highest base deficit |
9.0 ± 7.0 |
13.1 ± 6.9 |
0.44 |
|
Lowest arterial pH |
7.24 ± 0.10 |
7.14 ± 0.13 |
0.66 |
|
Lowest hourly urinary output (mL/h) |
47 ± 48 |
44 ± 68 |
0.85 |
MAP: presiunea arteriala medie; IAP: presiunea intra-abdominala; APP: presiunea de perfuzie abdominala.
O IAP de 9 mm Hg a avut cea mai buna sensibilitate (65%) si specificitate (72%) pentru stabilirea prognosticului pacientului, totusi aceasta valoare a IAP poate sa fie nerealista pentru o populatie de pacienti cu stare mult mai grava. Cum numai 18% din pacientii din acest studiu au avut semne de IAH si numai 2% au avut ACS (definit ca IAP>20 mm Hg), rezultatele acestui studiu sugereaza faptul ca APP se poate folosi ca endpoint al resuscitarii nu numai la pacientii cu IAH sau ACS, ci si la categoria mai larga a tuturor pacientilor din Terapie Intensiva.
STUDIUL II
Grupul de studiu CIAH (The Critically Ill and Abdominal Hypertension) a facut ulterior un studiu prospectiv multicentric international in care la 257 pacienti s-a facut screening pentru IAH (definita ca IAP≥12 mm Hg). Au fost 47% pacienti medicali, 28% chirurgie programata, 17% chirurgie de urgenta si 9% traumatisme. Mortalitatea generala a pacientilor in spital a fost 35% (48% la pacientii medicali, 11% la cei cu operatii programate, 44% in chirurgia de urgenta, si 18% la traumatisme). Situatiile care s-au asociat cu aparitia IAH includ acidoza, hipotermia, transfuziile multiple, resuscitarea volemica, tulburarile de coagulare, sepsisul, chirurgia abdominala, ileusul, si disfunctia hepatica. IAP a fost corelata semnificativ cu aparitia insuficientei organice si cu mortalitatea. APP a fost semnificativ mai mica la pacientii care nu au supravietuit (54 ± 16 vs. 69 ±23 mm Hg; p<0.0001); la fel a fost si MAP (68 ± 15 vs. 81 ±23 mm Hg; p<0.0001), in timp ce IAP a fost semnificativ mai mare (15 ± 6 vs. 12 ± 5 mm Hg; p<0.0001). In subgrupul celor 145 de pacienti cu IAH, APP a fost de asemenea semnificativ mai mica la cei care nu au supravietuit (52 ± 14 vs. 65 ± 23 mm Hg; p<0.001), in timp ce IAP nu a mai fost diferita (17 ± 5 vs. 17 ±4 mm Hg), confirmand superioritatea folosirii APP ca predictor al prognosticului clinic. Aria de sub curba ROC a fost 0,732 pentru APP si 0,678 pentru IAP. O APP de 60 mm Hg a avut cea mai buna sensibilitate (79%) si specificitate (62%), in timp ce o MAP de 70 mm Hg a avut o sensibilitate de 69% si o specificitate de 61%. O valoare-prag a IAP de 12 mm Hg a avut o sensibilitate de 75% si o specificitate de 59%.
Pe baza acestor studii grupul de studiu CIAH a recomandat mentinerea APP peste 60 mm Hg si a IAP sub 12 mm Hg pentru optimizarea prognosticului pacientului.
Studiul CIRFAH (Critically Ill Renal Failure and Abdominal Hypertension) a evaluat prospectiv IAP si APP ca predictori ai prognosticului la 60 de pacienti cu insuficienta renala acuta (IRA) (definita de o creatinina serica > 2 mg/dL). Intr-o perioada de 12 luni, pacientilor admisi cu, sau care au facut IRA in timpul stationarii in Terapie Intensiva, li s-a facut screening pentru IAH (definita ca IAP>12 mm Hg) prin masurarea presiunii intravezicale. IAP a fost notata de doua ori pe zi impreuna cu valoarea APP maxime si minime, balanta hidrica, si scorul SOFA (Sequential Organ Failure Assessment). Au fost 78% pacienti medicali si 22% pacienti chirurgicali. Scorul renal SHARF-II (Stuivenberg Hospital Acute Renal Failure) a fost 67 ± 22 la admisie si 76 ± 24 dupa 48 de ore. Scorul SOFA in prima zi a fost 9,4 ± 3,5 cu 1,7 ± 1,1 insuficiente organice. IAP in prima zi a fost 12 ± 5 mm Hg, iar APP a fost 55 ± 18 mm Hg. IAP maxima dupa 48 de ore (IAPmax) a fost 14 ± 6 mm Hg. IAH > 12 mm Hg in primele 48 de ore de la includerea in studiu a fost gasita la 63% dintre pacienti. Datele de la 46 de pacienti indica o mortalitate la 28 de zile de 63%. Prognosticul nu a fost diferit prin prezenta IAH, desi cei care nu au supravietuit au avut o IAP semnificativ mai mare si o APP mai mica in ziua a treia (Figura 2).
Figura 2. Evolutia IAP si APP la pacientii cu insuficienta renala acuta clasificati in supravietuitori si nesupravietuitori.
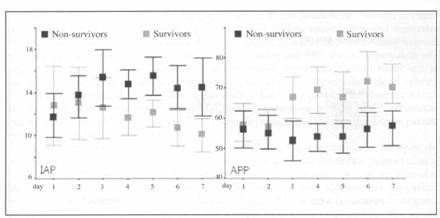
A existat o tendinta spre o balanta hidrica zilnica pozitiva si o balanta hidrica neta cumulativa pozitiva la cei care nu au supravietuit. Astfel incidenta IAH este mare la pacientii cu IRA si se asociaza cu o mortalitate semnificativa care este subestimata de scorurile de gravitate clasice. Scorul SHARF-II prezice mai bine prognosticul acestor pacienti. Persistenta IAH si a unei APP mici pana in ziua a treia a facut distinctia dintre supravietuitori si nesupravietuitori. Monitorizarea indeaproape a IAP si APP este astfel justificata la pacientii cu IRA.
2.8.1.4. Analiza statistica a datelor.
VEZI DIN SUBPUNCTUL ANTERIOR
Aplicatii clinice
Tratamentul inceput devreme cu scopul de a restabili perfuzia prganelor si aportul de oxigen la nivel celular este esential pentru reducerea morbiditatii si mortalitatii. Deoarece IAP critica difera de la pacient la pacient, doar IAP singura nu poate fi folosita ca scop terapeutic la aceasta categorie de pacienti. APP, calculata ca MAP minus IAP, evalueaza nu numai severitatea IAP, dar si caracterul adecvat al perfuziei abdominale. APP este o marime usor de calculat care s-a demonstrat ca depaseste rata de predictie clinica a IAP in primele trialuri clinice. APP imbunatateste sensibilitatea IAP mentinand specificitatea diagnostica, si pare sa se coreleze bine cu perfuzia viscerala. Timpul si studiile viitoare vor stabili daca APP sau poate un alt parametru al resuscitarii inca nedefinit, isi vor dovedi utilitatea in studii clinice mari.
Coreland rezultatele studiilor de mai sus cu literatura deja disponibila referitoare la consecintele fiziopatologice ale IAH si managementul ACS, se poate propune un algoritm pentru managementul adecvat al pacientului cu IAP crescuta (Figura 3).
Figura 3. Algoritm pentru resuscitarea IAH / ACS.

In primul rand, masuratorile seriate ale IAP trebuie facute cu generozitate la pacientii critici, din cauza incidentei crescute a IAH la acesti pacienti si a morbiditatii si mortalitatii sale. Din cauza ca examinarea fizica este insuficienta pentru identificarea IAP crescute, in prezent masuratorile seriate ale IAP sunt singura metoda disponibila prin care IAH se poate diagnostica cu acuratete si se poate directiona tratamentul. Monitorizarea presiunii intravezicale poate fi facuta rapid si necostisitor fara echipament specializat de monitorizare, folosind materiale disponibile in orice Terapie Intensiva.
In al doilea rand, decompresiunea abdominala imediata trebuie facuta la orice pacient care prezinta cresteri semnificative ale IAP sau semne de ACS. La pacientii chirurgicali asta se poate face fie prin crearea sau prin redeschiderea inciziei de laparotomie si inchiderea temporara a abdomenului. In functie de stabilitatea hemodinamica, acest lucru se poate face fie in sala de operatie sau la patul pacientului din Terapie Intensiva. Nu trebuie sa ne temem de o astfel de procedura sau sa o amanam, deoarece decomprimarea facuta rapid dupa diagnosticarea ACS imbunatateste dramatic functia organelor si supravietuirea. Un studiu recent al prognosticului pe termen lung a demonstrat lipsa unor deficite reziduale fizice sau mentale semnificative, si revenirea la o functionalitate normala la 12 luni la pacientii care au necesitat decomprimarea abdominala de urgenta. La pacientii medicali la care IAH este secundara acumularii lichidului de ascita sau a fluidelor folosite la resuscitare, paracenteza trebuie considerata drept o alternativa viabila la decompresiunea abdominala deschisa. Lasarea cateterului de paracenteza pe loc pana cand starea pacientului se stabilizeaza permite drenajul continuu al lichidului peritoneal, reducerea IAP si o incidenta redusa a ACS tertiar sau recurent. Pacientii la care IAH este secundar hemoragiei retroperitoneale, edemului visceral, sau ileusului vor beneficia cel mai mult de pe urma decompresiunii abdominale, pentru ca paracenteza nu va reduce eficient severitatea IAH si nu va restabili perfuzia organelor.
In al treilea rand, la pacientii cu IAH care nu necesita decomprimarea imediata, APP trebuie mentinuta peste 50-60 mm Hg prin resuscitare volemica si medicatie vasoactiva. Volumul intravascular trebuie optimizat, iar vasopresoarele sunt rezervate pentru acei pacienti care continua sa aiba o APP inadecvata in ciuda resuscitarii volemice corespunzatoare. Poate fi luata in considerare masurarea statusului volumului intravascular prin Indicele volumului ventriculului drept la sfarsitul diastolei (right ventricular end-diastolic volume index RVEDVI) sau prin masurarea volumului sanguin intratoracic (intrathoracic blood volume ITBU). Masuratorile traditionale ale presiunilor de umplere intracardiace cum ar fi Presiunea de ocluzie a arterei pulmonare (PAOP) si Presiunea venoasa centrala (PVC) sunt inexacte in prezenta IAH si a presiunii intratoracice crescute si a pune baza pe acesti parametri poate conduce la o resuscitare insuficienta.
In al patrulea rand, imposibilitatea mentinerii unei APP de cel putin 50 mm Hg este indicatie pentru decomprimarea abdominala deschisa si inchiderea temporara a abdomenului pana cand starea clinica a pacientului se imbunatateste. Odata ce abdomenul a fost deshis, IAP trebuie monitorizata in continuare deoarece IAH si ACS, contrar aparentelor pot sa apara si intr-un abdomen deschis. La un pacient cu abdomenul deschis, imposibilitatea mentinerii unei APP adecvate este indicatie pentru o si mai mare decomprimare a abdomenului fie printr-o laparotomie mai mare sau inchiderea temporara a abdomenului mai laxa, mai complianta.
Cinci, tentativele de inchidere a abdomenului dupa decompresiune trebuie ghidate de IAP si APP. APP se poate folosi nu numai pentru a lua decizia dificila de a efectua laparotomia decompresiva, dar si pentru a rezolva problema adesea si mai grea a alegerii momentului si a modului de inchidere a abdomenului. In cazul cresterii persistente a IAP cu valori la limita ale APP trebuie facuta grefarea cu piele a viscerelor expuse, si nu trebuie incercata inchiderea peretelui abdominal sub tensiune. Inchiderea sub tensiune va duce cu siguranta la recurenta IAH, scaderea perfuziei viscerale si cresterea riscului dehiscentei.
In concluzie estimarea APP este superioara folosirii numai a IAP ca endpoint al resuscitarii la pacientii cu IAH sau ACS, deoarece APP evalueaza si severitatea IAH si perfuzia organelor. APP este superioara si markerilor generali ai resuscitarii cum ar fi pH-ul arterial, deficitul de baze, si acidul lactic arterial, prin capacitatea sa de a identifica rapid perfuzia viscerala inadecvata. O APP de 50 mm Hg sau mai mare este endpointul resuscitarii la pacientul cu IAP crescuta.
Comentarii
Rao R Ivatury
Cheatham and Malbrain, distinsii mei co-editori si campioni ai cauzei hipertensiunii intraabdominale si sindromului de compartiment abdominal, descriu in acest capitol notiunea de presiune de perfuzie abdominala, care in viitor poate sa revolutioneze modul cum interpretam presiunea intra-abdominala.
Autorii aduc dovezi puternice despre motivele pentru care 'presiunea transmurala' efectiva (presiunea de perfuzie, presiunea de perfuzie dintr-un compartiment, presiunea transabdominala, presiunea trans-toracica si altele asemenea), inspirate dupa modelul presiunii de compartiment de la nivelul membrelor, este important sa nu fie pierduta din vedere. Autorii argumenteaza convingator ca APP este superioara masurarii aleatorii numai a IAP. Ei propun si o secventa de 5 pasi terapeutici pentru a corecta o APP anormal scazuta. Daca credem in conceptul de presiune transmurala sau presiune de perfuzie care determina perfuzia, ca in cazul toracelui sau rinichiului, atunci este logic sa urmarim aceste presiuni de perfuzie (APP), si nu doar valorile absolute ale presiunii (IAP).
Evident, valabilitatea unui concept, oricat de solid ar fi el, consta in validarea clinica. Studiile viitoare, pe baza unor rezultate solide, vor stabili valoarea acestui concept. Pana atunci este logic sa consideram APP drept cel mai potrivit indicator.
2.8.1.5. Interpretatea rezultatelor.
Importanta
monitorizarii precoce, frecvent PIA
Evaluarea si gestionarea pacientii in stare critica
necesita evaluarea mai multe piese de laborator clinic, si informatii
fiziologice. Deoarece
hipertensiune intra-abdominale severe determina modificari fiziologice, precum
si date care induc in eroare, cum ar fi CVP si presiunea pulmonara ocluzie
arteriala, este important pentru clinician sa cunoasca pacientii presiunii
intra-abdominale pentru a putea sa evalueze intregul scenariu clinice. In plus, spre deosebire de multe in cazul
in care conditiile de ingrijire de sustinere este tot ceea ce este posibil,
exista interventii pentru tratarea tensiunii crescute intra-abdominale. Din
aceste motive, toti pacientii cu risc de a dezvolta HIA ar trebui sa aiba
presiune intra-abdominale masurate, trended si inregistrate.
Cresterea presiunii intra-abdominale este un proces clinic
tacut, care nu este PPAarent pana cand boala este bine a progresat. [1, 2]
Detectarea hipertensiune intra-abdominale necesita devreme un indice ridicat de
suspiciune, recunoasterea simptomelor precoce si o metoda pentru a masura in
mod constant PPAlied intra-abdominale presiune. Din pacate, examenul clinic
este de notorietate inexacte. [1, 2] Kirkpatrick et al efectuat un studiu care
a comparat masurat presiunea intra-abdominale la examen clinic medic. [1] Ei au
descoperit ca judecata clinica nu a reusit sa detecteze hipertensiune
semnificative intra-abdominale peste 40% din timp. Sugrue, et al au
gasit rezultate similare. [2] Ambii autori concluzia ca examenul clinic este de
incredere si de a recomanda monitorizarea de rutina presiunii intra-abdominale.
Din moment ce examenul clinic este inexact, depistarea
precoce a cresterii presiunii intra-abdominale necesita o metoda fiabila,
reproductibila de masurare a acesteia. In plus, metoda ar trebui sa fie destul
de simplu pentru ca personalul de ingrijire este dispus sa faca masuratori
frecvente pentru a permite depistarea precoce a cresterii PIA. Din cauza
faptului ca literatura recenta ca pacientii care dezvolta ACS in cat mai putin
de 6-8 ore, este, probabil, rezonabil pentru a sugera masuratorile initiale fie
luate cel putin la fiecare 1-2 ore, pana la o tendinta clara este stabilita (a
se vedea algoritmul de monitorizare a PIA). [3] Pana in prezent, cea mai sigura
metoda este prin transductia presiune printr-un cateter in cavitatea
peritoneala. Alte optiuni includ mai putin invazive transductia presiune
printr-un tub introdus in stomac, vezica urinara, sau rect [1, 2] Din aceste
optiuni, Obeid et presiune al vezicii urinare sa constatat ca cel mai strans reflecta
presiune intraperitoneala si a fi cele mai fiabile punct de vedere tehnic.. [
4] Alti autori confirma constatarile lui Obeid. [5] presiuni vezicii urinare
luate printr-un cateter Foley se coreleaza foarte strans cu presiuni masurate
direct in cavitatea abdominala si devin principala metoda de monitorizare a
presiunii intra-abdominale.
2.8.2. PPA.
Intra-abdominal pressure and abdominal perfusion pressure
Although
intra-abdominal pressure clearly correlates with patient outcome, the PIA at
which an individual patient develops problems is highly variable and dependent
upon a numerous factors including patient comorbidities and mean arterial blood
pressure. This insight led to the concept of abdominal perfusion pressure as a
better method to assess end organ perfusion and resuscitation endpoints. The
amount of blood flow (and therefor oxygen delivery) delivered to
intra-abdominal tissue is directly impacted by both the pressure resisting flow
(intra-abdominal pressure: PIA) and the pressure head delivering that blood
(mean arterial pressure: PAM). This pressure is called Abdominal Perfusion
Pressure: PPA (PAM - PIA = PPA). Abdominal perfusion pressure is more
predictive of survival than either PAM or PIA according to several recent
abstracts and published studies. [1, 2] In the future, adequate PPA may be the
primary endpoint that intensivists consider during the management of patients
suffering from intra-abdominal hypertension.
The concept of abdominal perfusion pressure is similar to the concept of
cerebral perfusion pressure that is used in neuro-critical care when monitoring
intracranial pressure. Because the brain is enclosed within a non-compliant
bony container (the skull), as the volume within the brain expands, the
pressure within the brain begins to increase. At a critical volume there is no
additional space and the pressure dramatically increases, leading to
significant tissue ischemia due to reduction in blood flow (see diagram of
Monro-Kellie Doctrine).
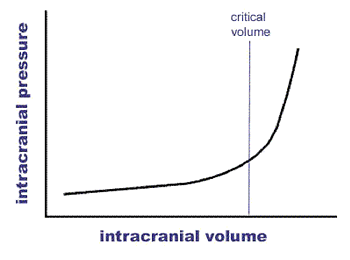
While the abdominal cavity is more compliant than the skull, it is not freely compliant and becomes increasingly rigid as it distends. At some point the compliance of the abdominal wall drops dramatically and the pressure begins to increase precipitously in a similar fashion as that shown in the Monro-Kellie diagram. At that point, abdominal perfusion pressure drops dramatically and significantly worsening intra-abdominal organ ischemia occurs. Attempts to maintain abdominal perfusion pressure and provide adequate intra-abdominal organ blood flow are instrumental to improving patient survival. [1] A management strategy that includes frequent PIA monitoring, optimization of abdominal perfusion pressure (greater than 50 to 60 mm Hg preferred) through careful fluid and vasopressor support, medical interventions to reduce PIA, and immediate abdominal decompression should PIA continue to rise or PPA remain inadequate is necessary to ensure optimal patient survival. (See Management Algorithm for a graphic display of such a management method). Utilizing an PPAroach like this, Cheatham et al were able to improve patient outcomes - reducing the incidence of ACS from 64% to 43% and reducing patient mortality from 44% to 28% in a high risk surgical population.[1]
2.8.2.1. Definitie.
2.8.2.2. Modalitati de masurare.
2.8.2.3. Colectarea datelor.
2.8.2.4. Rezultate.
2.8.2.5. Analiza statistica a datelor.
2.8.2.6. Interpretatea rezultatelor.
2.8.3. PaO2
2.8.3.1. Definitie.
2.8.3.2. Modalitati de masurare.
2.8.3.3. Colectarea datelor.
2.8.3.4. Rezultate.
2.8.3.5. Analiza statistica a datelor.
2.8.3.6. Interpretatea rezultatelor.
2.8.4. PaCO2
2.8.4.1. Definitie.
2.8.4.2. Modalitati de masurare.
2.8.4.3. Colectarea datelor.
2.8.4.4. Rezultate.
2.8.4.5. Analiza statistica a datelor.
2.8.4.6. Interpretatea rezultatelor.
2.8.5. Frecventa respiratorie
2.8.5.1. Definitie.
2.8.5.2. Modalitati de masurare.
2.8.5.3. Colectarea datelor.
2.8.5.4. Rezultate.
2.8.5.5. Analiza statistica a datelor.
2.8.5.6. Interpretatea rezultatelor.
2.8.6. pH-ul
VEZI SI LA STUDIUL I PPA REFERIRE LA pH
2.8.6.1. Definitie.
2.8.6.2. Modalitati de masurare.
2.8.6.3. Colectarea datelor.
2.8.6.4. Rezultate.
2.8.6.5. Analiza statistica a datelor.
2.8.6.6. Interpretatea rezultatelor.
2.8.7. PVC c
2.8.7.1. Definitie.
2.8.7.2. Modalitati de masurare.
2.8.7.3. Colectarea datelor.
2.8.7.4. Rezultate.
2.8.7.5. Analiza statistica a datelor.
2.8.7.6. Interpretatea rezultatelor.
2.8.8. TAM
2.8.8.1. Definitie.
2.8.8.2. Modalitati de masurare.
2.8.8.3. Colectarea datelor.
2.8.8.4. Rezultate.
2.8.8.5. Analiza statistica a datelor.
2.8.8.6. Interpretatea rezultatelor.
2.8.9. Scorul Glasgow
2.8.10.1. Definitie.
2.8.10.2. Modalitati de masurare.
2.8.10.3. Colectarea datelor.
2.8.10.4. Rezultate.
2.8.10.5. Analiza statistica a datelor.
2.8.10.6. Interpretatea rezultatelor.
2.8.10. Diureza
2.8.11.1. Definitie.
2.8.11.2. Modalitati de masurare.
2.8.11.3. Colectarea datelor.
2.8.11.4. Rezultate.
2.8.11.5. Analiza statistica a datelor.
2.8.11.6. Interpretatea rezultatelor.
2.8.11. Creatinina
2.8.12.1. Definitie.
2.8.12.2. Modalitati de masurare.
2.8.12.3. Colectarea datelor.
2.8.12.4. Rezultate.
2.8.12.5. Analiza statistica a datelor.
2.8.12.6. Interpretatea rezultatelor.
9. Interpretarea rezultatelor.
10. Stabilirea structurii scorului.
11. Discutii.
12. Anexe.

PPA
VEZI FISIERUL RECOMANDARI PENTRU STUDII
RECOMANDARI PENTRU STUDII --http://www.wsacs.org/research_recommendations.php
|
Nr. Caz: _ _ _ _ |
Data int:/ /200_ |
Data ext: |
|
|||||||||||||||||||||||||||||||||||||||||
|
Nume: |
Prenume: |
Varsta: |
|
|||||||||||||||||||||||||||||||||||||||||
|
Diagnostic: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Interventia chirurgicala: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Data interventiei: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Cauza etiologica a cresterii PIA: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Ziua de internare: |
1 //04 |
2 //04 |
3 //04 |
4 //04 |
5 //04 |
6 //04 |
7 //04 |
8 //04 |
9 //04 |
|
||||||||||||||||||||||||||||||||||
|
TAM |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
PIA |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
PPA |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Ziua de internare: |
10 //04 |
11 //04 |
12 //04 |
13 //04 |
14 //04 |
15 //04 |
16 //04 |
17 //04 |
18 //04 |
|
||||||||||||||||||||||||||||||||||
|
TAM |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
PIA |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
PPA |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Evaluarea factorilor predispozanti (anteriori aparitiei SCA): |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Sepsisul: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Acidoza: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Coagulopatii: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Politransfuzionati: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Disfunctie hepatica cu SCAita: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Forma clinica: |
Hiperacuta: □ |
Acuta: □ |
Subacuta: □ |
Cronica: □ |
|
|||||||||||||||||||||||||||||||||||||||
|
Efectele PIA asupra sistemului respirator |
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
Respira spontan: □ Ventilat mecanic: □ (ziua: valoarea) |
|
||||||||||||||||||||||||||||||||||||||||||
|
Frecventa: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Pres inspir max |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Vol Tidal |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Auto PEEP |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
CO2 |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Oximetria: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Modificari radiologice: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Aparitia complicatiilor pulmonare (infectioase): |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Antecedente respiratorii: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Efectele PIA asupra sistemului cardiovascular: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
PVC: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Debit cardiac: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Frecventa cardiaca: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Tromboza venoasa / embolie: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Stop cardiac: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Efectele PIA asupra SNC |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Semne de crestere a presiunii intracraniene: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Semne de scadere a perfuziei cerebrale: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Efectele PIA asupra functiei gastro-intestinale: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Ex clinic al abdomenului: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Circulatie portocava: |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Efectele PIA asupra functiei renale |
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
||||||||||||||||||||||||
|
Diureza |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
Semne clinice: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Medicatie diuretica: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Biologic: |
|
|||||||||||||||||||||||||||||||||||||||||||
|
Sange |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
pH |
7,35-7,45 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
PCO2 |
36-44 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
pO2 |
70-100 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Bicarbonat |
22-26 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
VSH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Eritrocite |
4-5,5mil/mm3 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
HT |
36-46/42-52% |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
L |
4-9000/mm3 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
T |
140-440.000/mm3 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Fibrinogen |
200-400mg% |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Ser/plasma |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Amilazemie |
<120U/l |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Fos alc |
22-170 U/L |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
BT |
0,2-1,1 mg% |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
BD |
<0,3 mg% |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
BI |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Glicemie |
70-100 mg/dl |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
TGO(ASAT) |
<15; <19 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
TGP(ALAT) |
<19; <23U/L |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Uree |
10-50 mg/dl |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
K |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Creatinina |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Na |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Colesterol |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
Tratament |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
1) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
2) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
3) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
4) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
5) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
6) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
7) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
8) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
9) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
10) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
11) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
12) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
13) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
14) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
15) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
16) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
17) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
18) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||

These findings indicate that lAP is important in understanding chest wall behaviour, not only from a scientific point of view, but also from a clinical one.
1) Interpretation of respiratory mechanics: Data relative to the total respiratory system mechanics may not be considered always representative of the lung alone. Thus, if a physician measures the respiratory system elastance alone to have an idea of the lung elastance he may be misled if lAP is not taken into account. These concepts are valid both during general anaesthesia in patients with increased lAP, as in case of morbid obesity, and in ALl! ARDS.
2) Etiology of ARDS: The measurement of lAP and chest wall mechanics may playa relevant role in the recognition of the two forms of ARDS, 'direct' and 'indirect', likely leading to an improvement in clinical management. Two major complications of positive pressure ventilation in patients with ARDS are baro-volutrauma and hemodynamic impairment, both related to the elevated elastance of the respiratory system. High lung elastance and low chest wall elastance in 'direct' ARDS, in fact, result in elevated trans-mural pressure, a risk factor for barotrauma, and low pleural pressure, whereas lower lung elastance and higher chest wall elastance in 'indirect' ARDS results in elevated pleural pressure, with consequent possible impairment of venous return, cardiac filling, and cardiac output.
3) Current recommendations on the ventilatory treatment: The recommendations of the consensus group regarding high airway pressure during the ventilatory management of ARDS emphasized that a plateau pressure of the respiratory system greater than or equal to 30 cm Hp is of concern and that reductions in tidal volume may be necessary. They went on to point out that if a clinical situation is associated with decreased chest wall compliance then a plateau pressure higher than 30 cm Hp may be acceptable. This is something that the more recent trials have not addressed. Lung distension is directly related to trans-pulmonary pressure. Normal lung will reach its maximum distension when a trans-pulmonary pressure reaches 30-35 cm
H20. Lung over-distension can usually be avoided by preventing trans-pulmonary pressure from exceeding 30-35 cm Hp.A treatment strategy which uses plateau pressure of the respiratory system as a surrogate for trans-pulmonary pressure may overestimate the true trans-pulmonary pressure.
4) Interpretation of hemodynamics: The different mechanical characteristics of the chest wall due to increased lAP influences the transmission in the pleural space of the airway pressure. In fact, for the same airway pressure, patients with lower chest wall elastance will have less increase in pleural pressure. On the contrary, patients, with higher chest wall elastance will have a much greater increase in pleural pressure. This means that the (compromise of) venous return to the heart is less affected, for the same airway pressure, in a patient with low chest wall elastance compared to a patient with a high chest wall elastance. Evident consequences are also related to the interpretation of the intravascular pressures, central venous pressure and wedge pressures and the effects of application of different airway pressures on hemodynamics.
Sepsis/SIRS + Volume Resuscitation = Intra-Abdominal Hypertension3-4>>>>>>>>>>>>>>>>>>>>>>>>>>>><<<<<<<<<<<<<<<<<
Monitoring IAP + Intervention = Reduced Organ Failure5-9

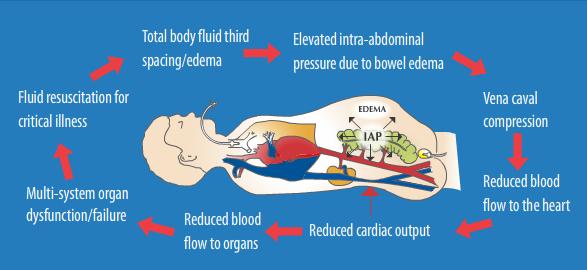
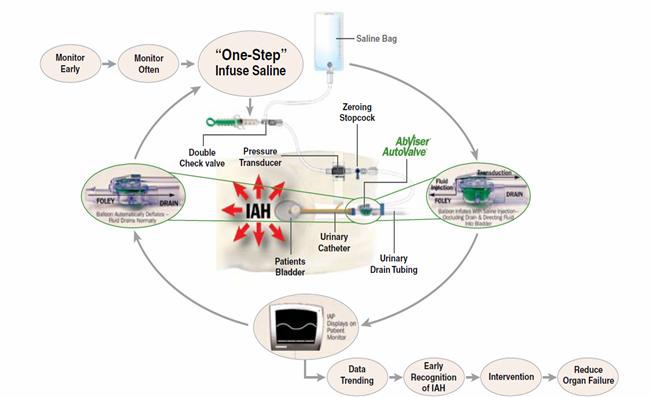
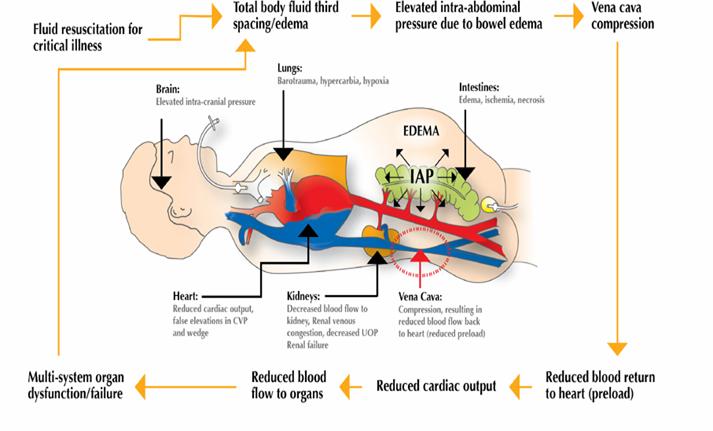
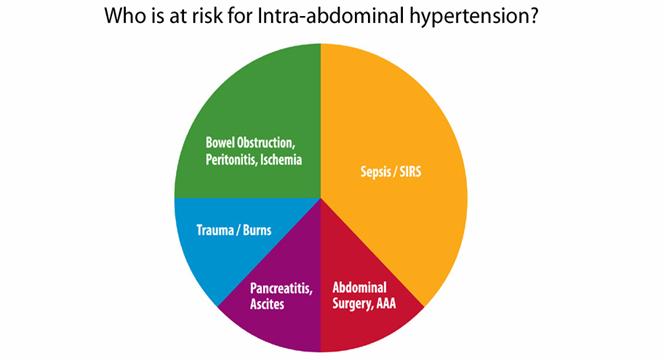
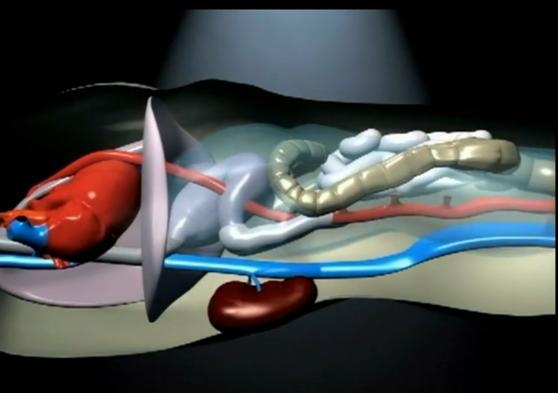
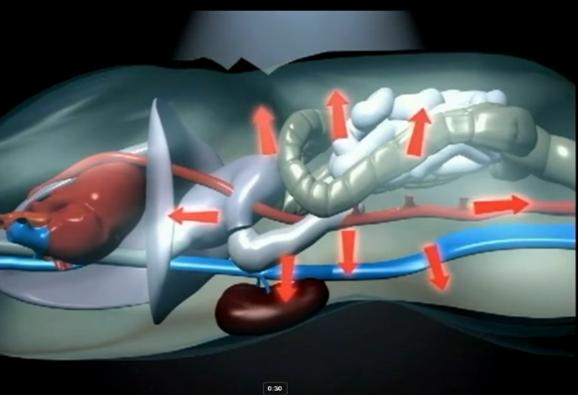
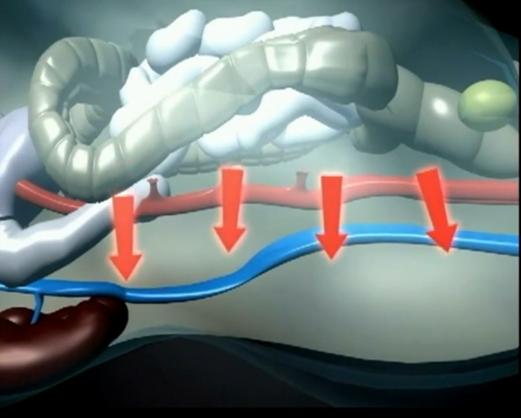
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Esee pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








