
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Microscopie - fenomene de transport |
Microscopie - fenomene de transport
Microscopie - Fenomene de transport
I. Notiuni teoretice
1. Difuzia
Difuzia pasiva reprezinta fenomenul de transport pasiv, datorat agitatiei termice, a unor particule din zonele de concentratie, densitate mai ridicate, spre zonele cu valori mai mici ale acestor marimi, printr-un mediu suport omogen.
Fenomenul de difuzie pasiva este cel mai intens la gaze, unde viteza termica este foarte mare si cel mai lent in cazul solidelor, unde moleculele (sau ionii) au pozitii relativ fixe in spatiu.
Inainte de a prezenta legile difuziei, vom face unele precizari in legatura cu anumiti termeni folositi: flux si gradient.
Fluxul reprezinta cantitatea de substanta, sarcina, energie transportata printr-o suprafata in unitatea de timp.
Prin gradient se intelege variatia unei marimi (concentratie, densitate, potential electric etc.) intre doua puncte ale spatiului, raportata la distanta dintre cele doua puncte.
In aceste conditii definim difuzia ca cel mai general tip de transport pasiv (spontan), produs de gradientul de concentratie (pentru gaze), sau de gradientul de activatate chimica (pentru materia conden-sata).
Difuzia pasiva intr-un mediu omogen se supune la doua legi, cunoscute sub numele de legile lui Fick:
(1) Cantitatea de substanta difuzata printr-o suprafata S, in unitatea de timp este proportionala cu aria suprafetei, cu gradientul de concentratie si depinde de conditiile de mediu. Factorul de proportiona-litate se noteaza cu D si reprezinta coeficientul de difuzie.
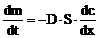
m=masa de substanta,
S=suprata de difuzie, D=coeficientul de difuzie, ![]() = gradientul de concentratie, t =
timpul.
= gradientul de concentratie, t =
timpul.
(2) Viteza de variatie a concentratiei este proportionala cu variatia spatiala a gradientului de concentratie.
![]()
Reprezentare grafica a variatiei de concentratie cu distanta (intr-un solvent) ofera o imagine a gradientului sub forma unei pante de-a lungul careia 'coboara' solvitul.

Figura 8.1. Reprezentarea schematica si grafica a dependentei concentratiei unui solvit (molecule difuzante) care se injecteaza in partea stanga a unui solvent (faza omogena).
Transportul de substanta prin difuzie conduce la modificarea concentratiei in fiecare punct al spatiului ocupat de ansamblul solvit-solvent, in final ajungandu-se la o egalizare a concentratiei.
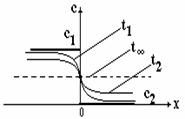
Figura 8.2. Distributia spatiala a concentratiei la diferite momente de timp (t0<t1<t2<ta) dupa inceperea procesului de difuzie, in urma contactului dintre solvit si solvent.
Prima lege a lui Fick permite calcularea cantitatii de substanta ce strabate o membrana permeabila:
![]()
unde: Dc = diferenta de concentratie, Dt = intervalul de timp.
Fie doua vase de volume V1 si V2 despartite de o membrana semipermeabila, ce contin solvent, respectiv o solutie de concentratie C0 cunoscuta.
|
In timpul difuziei lichidul din vasul V2 trece de la concentratia C0 la concentratia C2 (mai mica), iar in vasul V1 concentratia creste de la C01(=0) la C1. Conform legii conservarii masei se poate scrie relatia:
![]()
din care explicitand variatia masei:
![]()
se ajunge la coeficientul de permeabilitate al membranei:
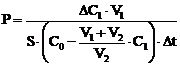
Problema in aceasta situatie o reprezinta determinarea concentratiei C1. Pentru aceasta se foloseste metoda conductometrica deoarece pentru substantele ionice, intre anumite limite ale concentratiei, aceasta este proportionala cu conductivitatea solutiei σ).
Conductanta este inverul rezistentei si se masoara in W-1 (mho)
![]()
2. Osmoza
In unele situatii solvitul este impiedicat sa difuzeze intre compatimente datorita existentei unei membrane semipermeabile. In aceasta situatie sistemul tinde spre o stare stationara (steady state) si nu spre o stare de echilibru, prin difuzia solventului prin membrana.
Osmoza duce la aparitia unei asimetrii a presiunii hidrostatice in sistemul considerat. Diferenta de presiune hidrostatica ce blocheaza difuzia solvitului se numeste presiune osmotica.
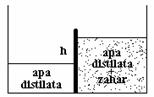
Figura 8.3 Procesul de osmoza.
Pentru solutii diluate presiunea este data de legea lui Van't Hoff:
![]()
unde: P = presiunea osmotica
n = numarul de moli de substanta osmotic activa dizolvati
R = constanta universala a gazelor
T = temperatura absoluta
In cazul solutiilor de electroliti se introduce un factor de corectie (i) dependent de gradul de disociere al electrolitului:
![]()
II. Parte experimentala
A. Determinarea concentratiei unor solutii ionice prin conductometrie
Materiale necesare
- sursa de tensiune 12V cc
- punte Wheastone
- electrozi
- solutii ionice de concentratie cunoscuta
Mod de lucru: Se realizeaza montajul experimental ca in figura 8.4. Se introduce prima solutie pana ce aceasta acopera complet electrozii, dupa care se apasa butonul (K) puntii; daca acul deviaza se va ajusta valoarea rezistentei pana la atingerea echilibrului puntii. Valoarea rezistentei se introduce in tabelul de mai jos. Se procedeaza analog si pentru celelalte solutii.
|
No. |
C (mol/l) |
R (W |
G (W-1 |
|
1 |
|
|
|
|
|
|
|
|
Se traseaza graficul conductanta = f (concentratie), iar cu ajutorul metodei celor mai mici patrate se traseaza curba ce se potriveste cel mai bine datele experimentale (vezi prelucrarea matematica a datelor).
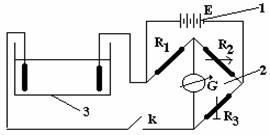
Figura 8.4. (1) sursa de tensiune, (2) punte Wheastone, (3) cuva cu electrozi.
B. Determinarea coeficientului de permeabilitate al unei membrane
Materiale necesare
- sursa de tensiune 12V cc
- punte Wheastone
- electrozi
- membrane sintetice
- vas de difuzie
- cronometru
Mod de lucru: Se realizeaza montajul experimental ca in figura 8.5. Se umple compartimentul din stanga al cuvei cu o solutie concentrata de NaCl iar cel din dreapta cu apa distilata. Se masoara conductanta solutiei din cuva cu electrozi la fiecare 3 minute. Datele obtinute se trec in tabelul de mai jos.
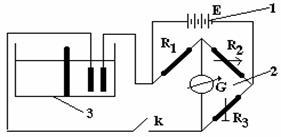
Figura 8.5. (1) sursa de tensiune, (2) punte Wheastone, (3) vas de difuzie.
|
No. |
t (min) |
R (W |
G (W-1 |
P (m/s) |
|
1. |
|
|
|
|
|
|
|
|
|
|
Sa se traseze garficele G = f(t) si R = f(t).
C. Determinarea presiunii osmotice a unor solutii
Materiale necesare
- osmometru
- membrane semipermeabile
- solutii de glucoza
- vas de 500ml
- apa distilata
Mod de lucru: Se monteaza la osmometru prima membrana, dupa care se introduce in vasul cu apa distilata pana cand suprafata lichidului din vas se afla la diviziunea 0 a osmometrului. Se introduce prima solutie de analizat in osmometru tot pana la diviziunea 0. Dupa 5 minute se masoara diferenta de nivel si se calculeaza presiunea osmotica a solutiilor. Datele se trec in tabelul de mai jos. Se goleste osmometrul, se spala cu apa distilata si se reia procedeul pentru solutiile urmatoare.
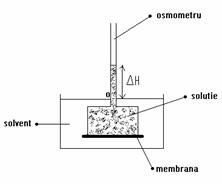
Figura 8.6 Determinarea presiunii osmotice cu ajutorul osmometrului.
|
No. |
Solutia |
Dh (mm) |
P (atm) |
|
1. |
|
|
|
|
|
|
|
|
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








