
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Hemograma automata |
Hemograma automata
HEMOGRAMA AUTOMATA
Hemograma automata reprezinta o baterie de teste compusa din doua seturi de baza: numararea completa in sange a (CBC=complete blood count) si numararea diferentiala a leucocitelor (DLC=differential leukocyte count). Intrucat in numeroase cazuri este ceruta numai numararea completa, in practica generala a multor laboratoare numararea completa si diferentiala se executa separat. Analizoarele automate uzuale ofera posibilitatea de testare la alegere a specimenelor de sange prin numarare completa sau diferentiala.
Numararea completa automata
Reprezinta o baterie de 7 pana la 10 teste sau parametri, in functie de tipul de instrumente folosit. In anii, '60, testarea consta din 7 parametri: numararea leucocitelor (Nr.L), numararea eritrocitelor (Nr.Er.) si urmatoarele determinari: hemoglobina (Hb) hematocritul (Ht), volumul eritrocitar mediu (VEM), continutul mediu de hemoglobina in eritrocite (HEM) si concentratia medie a hemoglobinei in eritrocite (CHEM). Numararea trombocitelor (Nr.Tr.) s-a adaugat primelor 7 determinari in anii '70. Dezvoltarea ulterioara a numararii automate a permis includerea a inca 2 parametri la inceputul anilor '80: variatia distributiei eritrocitelor (RDW=Red cell distribution width) si volumul trombocitar mediu (VTM). Dispunem astfel de 10 parametri standand ai numararii automate complete. Cu ajutorul analizorilor moderni dispunem si de urmatorii parametri aditionali: concentratia celulara medie in hemoglobina (CHCM=cellular hemoglobin concentration mean), variatia distristrubutiei hemoglobinei (HDW=hemoglobin distribution width), variatia distributiei trombocitelor (PDW=platelet distribution width) si volumul trombocitar procentual (PCT=plateletcrit).
1. Recoltarea si prelucrarea specimenelor de sange sunt componente premergatoare analizei automate. Si cei mai moderni analizori hematologici vor oferi rezultatele numai pe masura calitatii probelor furnizate. Erorile comise in faza recoltarii sau a prelucrarii preanalitice nu pot fi compensate. Atat pentru laborant cat si pentru clinician este esentiala intelegerea importantei acestor surse potentiale de erori. Erorile din faza anterioara analizei pot fi generate de: recoltarea specimenului, tipul anticoagulantilor, coagularea specimenului, temperatura de depozitare, perioada scursa intre recoltare si analiza, hemoliza, amestecarea probelor, hiperlipemia si alte anomalii metabolice sau biochimice. Cateva dintre cele mai frecvente surse de erori din faza preanalitica si analitica a CBC sunt prezentate in tabelul urmator:
Tabel XIII - Numararea automata: surse de erori preanalitice si analitice
|
Parametrul |
Cresteri artefactuale |
Scaderi artefactuale |
|
Nr. L. |
Crioglobuline Proteine monoclonale Heparina Aglutinarea trombocitelor Eritiocite nelizate Eritroblasti |
Coagulare Resturi celulare |
|
Nr. E. |
Crioglobuline Trombocite gigante Leucocitoza > 50x109/l |
Autoaglutinare Coagulare Hemoliza in vitro Microcitoza |
|
Hb. |
Crioglobulinemie Proteine monoclonale Carboxiheinoglobina (>10%) Hemoliza in vivo Heparina Hiperbilirubinemie Lipemie |
Coagulare |
|
Ht. |
Crioglobulinemie Trombocite gigante Lcucocitoza > 50x109/l Hiperglicemie |
Autoaglutinare Coagulare Hemoliza in vitro Microcitoza |
|
VEM |
Autoaglutinare Leucocitoza > 50x109/l Hiperglicemie |
Crioglobulinemie Trombocite gigante Hemoliza in vitro Microcitoza |
|
HEM |
Leucocitoza > 50x109/l Crestere falsa a Hb. Scadere falsa a Nr. Er. |
Scadere falsa a Hb. Crestere falsa a Nr. Er. |
|
CHEM |
Autoaglutinare Coagulare Hemoliza in vitro sau/si in vivo Crestere falsa a Hb. Scadere falsa a Ht. |
Leucocitoza > 50x109/l Scadere falsa a Hb. Crestere falsa a Ht |
|
Nr. Tr. |
Crioglobulinemie Hemoliza in vitro si in vivo Microcitoza Incluzii in eritrocite Fragmente de leucocite |
Coagulare Trombocite gigante Heparina Aglutinarea trombocitelor |
Numararea completa automata este efectuata din sangele venos. Specimene adecvate pot fi si sangele capilar (deget, calcai, lobul urechii) sau arterial.Anticoagulantul preferat este EDTA (acid etilendiaminotetraacetic) la o concentratie de 1,5 mg/ml sange. Specimenele clinice pot fi stocate la temperatura camerei pana la 6-8 ore, si la +4° C pana la 24 ore, fara sa se modifice Nr. L., Nr. Er., Nr.T r. si Hb.
Daca sangele este stocat pentru perioade mai lungi de timp se observa alterarea mai multor parametri: cresterea artefactata a VEM, scaderea CHEM etc. VTM pare sa fie cel mai putin stabil dintre parametrii analizati.
Lucrul cu aparatele de prima generatie implica o serie de activitati manuale ca: identificarea si etichetarea probelor, verificarea prezentei microcheagurilor, controlarea integritatii esantionului si omogenizarea (mixarea). Analizorii utilizati in mod curent sunt dotati cu sisteme interne de detectare a cheagurilor de sange, evalueaza calitatea mostrei aspirate si realizeaza mixajul. Instrumentele moderne poseda dispozitive de citire a codurilor cu bare, ce asigura identificarea cu precizie a pacientului si a specimenului si prelucrarea unei cantitati mari de specimene.
Aceste analizoare pot opera intr-un sistem cu eprubete inchise sau deschise. Avantajele sistemelor inchise sunt multiple: minimalizarea contactului lucratorilor cu sangele, deci a biohazardului; posibilitatea de a repeta analiza (eprubetele inchise au capace din materiale imbunatatite ce pot fi intepate de 4-5 ori de acul ascutit al analizorului fara a se compromite calitatea si cantitatea mostrei aspirate). Unii analizori au un sistem de pre-diluare care permite folosirea unor specimene chiar mai mici decat cele tipice (de 100-300 µl) si evitarea rezultatelor false provocate de aglutinarea la rece intrucat asigura preincalzirea sangelui si a diluentului; testele urgente pot fi inserate in pozitie prioritara fata de specimenele de rutina.
2. Analiza automata: principii. Tehnologia principala folosita in determinarile cantitative automate este citometria de flux. Un jet de fluid diluant ce contine suspensia celulara trece cu viteza mare prin fata unui senzor sau a unei raze de sondaj (curent electric sau laser). Diametrul jetului si apertura sunt proiectate sa permita trecerea unei singure celule. Fiecare celula este separata de urmatoarea printr-un volum anume determinat de lichid de dilutie. Interactiunea razei de sondaj cu celula produce un semnal care este proportional cu cantitatea acelei variabile ce va fi masurata pentru fiecare celula in parte: impedanta electrica (rezistenta), dispersia luminii, intensitatea fluorescentei, continutul in enzima. Informatiile sunt colectate caracteristic pentru 10 000 celule individuale si apoi sunt afisate pe ecranul unui computer si imprimate sub forma de histograme sau de scatergrame. Analizorii hematologici comerciali utilizeaza mai cu seama impedanta sau dispersia luminii, cu sau fara marcare citochimica pentru continutul in enzima.
Tabel XIV - Tehnicile utilizate de analizorii hematologici
|
Analizorul comercial |
Eritrocite |
Leucocite |
Trombocite |
|
Seria S-Plus (Coulter Electronics Hialeah, Florida, USA) |
Impedanta |
Impedanta |
Impedanta |
|
Seria Tehnicon H (Tehnicon, Tarrytown, New York, USA) |
Dispersia luminii |
Dispersia luminii si continut enzimatic |
Dispersia luminii |
|
ELT-8 (Oitho, Westwood, Massachussets, USA) |
Dispersia luminii |
Dispersia luminii |
Dispersia luminii |
|
Sysmex E-5000, NE-8000 (Toa, Baxter, McGraw Park Illinois, USA) |
Impedanta |
Impedanta |
Impedanta |
Analizorii Coulter dezvoltati dupa seria S-plus sunt: STKR S-Plus, analizorul VCS si in mod curent STKS. Seria STKR S-Plus utilizeaza aceeasi tehnologie (impedanta) ca si seria S-Plus anterioara, dar se include o auto-prelevare din probe de pana la 144 specimene pe ora. Analizorul VCS a fost introdus la finele anilor '80 si incorporeaza trei tehnologii diferite: impedanta volumetrica (V), conductibilitate (C), ce foloseste energie electromagnetica de inalta frecventa pentru analizarea compozitiei fizice si chimice a celulelor si un fascicol laser monocromatic prin care determina, pe baza dispersiei luminii (S=scattering), marimea celulei si caracteristicile suprafetei acesteia. (De aici acronimul aparatului: VCS).
Analizorul VCS a fost destinat numai analizei diferentiale si daca se doresc cifre absolute, pe langa numararea diferentiala, atunci Nr. L. trebuie determinat pe un alt instrument si apoi introdus manual in computerul VCS pentru calculare.
Din acest motiv, tehnologia VCS a fost ulterior combinata cu sistemul STKR S-Plus pentru a obtine un sistem total integrat, analizorul uzual Coulter STKS.
Indiferent de tipul de analizor bazat pe impedanta, singurul parametru al numararii complete care este determinat in mod diferit este concentratia de hemoglobina, ce se masoara direct prin metoda spectrofotometrica standard a cianmethemoglobinei.
|
Principiul de baza al analizoarelor bazate pe dispersia luminii este acela ca o singura celula trece prin zona senzorului (zona iluminata). Lumina dispersata este detectata cu ajutorul unui fotodetector si convertita intr-un impuls electric. Numarul de impulsuri determina numarul de celule numarate, iar amplitudinea impulsului este proportionala cu volumul celulei. Pentru a obtine o citograma bidimensionala, dispersia luminii este masurata la 2 intervale nesuprapuse (un unghi ascutit de 2,5°-3,5° si un unghi deschis, de 5°-15°). Spre deosebire de analizorii bazati pe impedanta, instrumentele cu dispersarea luminii folosesc sfericitizarea si fixarea izovolumetrica a eritrocitelor, fapt ce permite determinarea directa a concentratiei de hemoglobina, inlaturand necesitatea unei metode spectrofotometrice separate.
In toate tipurile de analizoare, parametrii masurati direct sunt: Nr. Er, Hb,VEM, RDW, Nr. L., Nr. Tr. si VTM; valorile Nr. Er., Nr. L. si Nr. Tr. se bazeaza pe numararea celulelor; valorile VEM si VTM se bazeaza pe marimea celulelor, iar RDW este coeficientul de variatie (CV) sau de deviatie standard (SD) a distributiei eritrocitelor dupa marime. Ceilalti trei parametri sunt calculati automat dupa valorile parametrilor masurati.
![]()
![]()
![]()
![]()
Rezultatele obtinute cu analizori hematologici automati sunt exacte, precise si sigure intr-o gama larga de valori, cu conditia ca specimenele de sange sa fie corect recoltate, anticoagulate si prelucrate, ca analizorii sa fie calibrati si intretinuti cum se cuvine si sa fie folositi martori de calitate corespunzatori.
In general limitele de variatie pentru parametrii masurati direct sunt:
Nr. L. 0,l-99xl09/L
Nr. Er. 0,4-8,0x 1012/L
Hb 2-25 g/dL
Nr. Tr. 10-999x109/L
Valorile coeficientului de variatie (CV) la toti parametrii CBC, cu exceptia Nr. Tr, sunt mai mici de 2%. La un Nr. Tr. ≥ 50x109/L, CV este mai mic de 5%, iar la unNr. Tr. < 50xl09/L, CV este de 5-10%. Daca un specimen de sange anume prezinta un numar de celule in afara limitei de variatii, sau daca este prezenta o distributie sau o morfologie anormala, atunci rezultatele automate ale CBC sunt semnalizate de analizori pentru o noua verificare. Operatorul analizatorului revede rezultatele inainte de a le comunica, coreleaza valoarea semnalizata cu evaluarea morfologiei si repeta analiza sau recoltarea, sau recurge la prelucrari speciale, dupa caz.
3. Histogramele rezultate din numararea automata. Pe langa valorile numerice ale diferitelor celule si de indicii celulari, toate tipurile de analizori hematologici produc histograme (pentru eritrocite, leucocite si trombocite), citograme sau scatergrame. In cazul eritrocitelor si al trombocitelor, histogramele arata distributia marimilor celulelor, prin reprezentarea grafica a numarului de celule in functie de volumul lor. Histograma leucocitelor (fig. 1) a fost disponibila incepand cu primele modele de analizori bazati pe impedanta si prezinta in mod normal o distributie a leucocitelor cu trei picuri: limfocitele, monocitele si granulocitele (in functie de volumele celulare crescande).
Citogramele si scatergramele sunt inregistrari grafice bi- sau tridimensionale de parametri multipli folositi pentru a deriva numararile diferentiale. Histogramele, citogramele si scatergramele nu sunt incluse in rezultatul final primit de medic. Cu toate acestea, ele contin informatii utile operatorului privind controlul calitatii rezultatelor elaborate si promovarea investigatiilor ulterioare asupra rezultatelor semnalizate ca anormale.
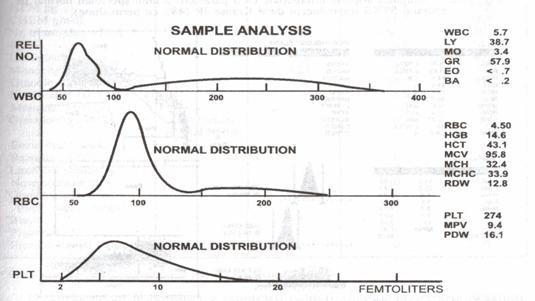
Fig. 9 Histograma diferentiala cu 3 parametri a unui specimen normal, realizata cu Coulter S-Plus IV (reprodusa cu permisiunea lui Krause JR, 1994)
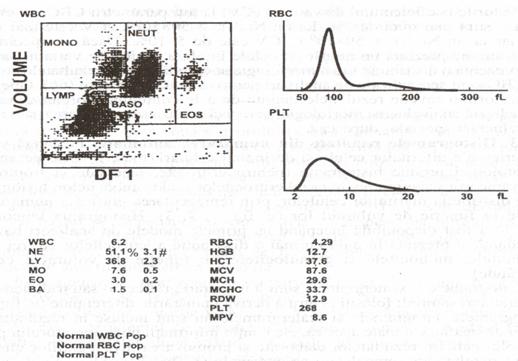
Fig. 10 Imaginea analizei diferentiale cu 5 parametri a unui specimen normal pe aparatul STKS (reproducere dupa Krause Jr., cu permisiune).
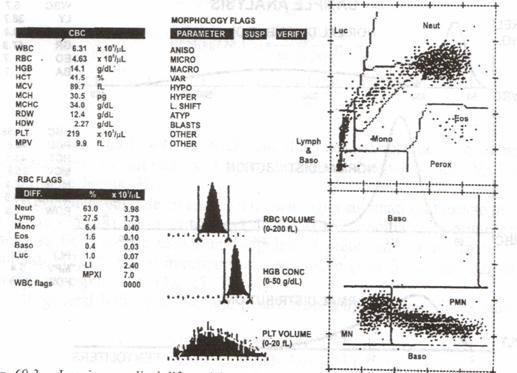
Fig.11 - Imaginea analizei diferentiale cu 5 parametri a unui specimen normal, cu Tehnicon H- 1. Citograma de sus este data de canalul peroxidazei, citograma de jos este
data de canalul de lobularitate (laser) a bazofilelor (reproducere dupa Krause JR 948) cu permisiune).
Fiecare laborator poate avea un sistem diferit de control al calitatii, al formei de raportare ca si criterii proprii de verificare morfologica a frotiurilor. Mai mult, nivelurile de referinta ("normale') ale parametrilor numerici pot fi stabilite in cadrul institutiei, din evaluarea unui numar corespunzator de indivizi din punct de vedere hematologic si proveniti dintre pacientii proprii. Alternativ, pot fi utilizate nivelurile de referinta publicate in literatura de specialitate.
Aceste cifre normale de referinta vor fi incluse in comunicarile finale iar rezultatele anormale vor fi semnalizate.
Tabelul XV prezinta exemple de cifre de referinta, precum si valorile mici si cele mari considerate suficient de severe pentru a indreptati comunicarea lor imediata medicului (valori de "alerta" sau de "panica").
Tabelul XV - Limitele valorilor de referinta si valori "de panica" in hematologie
|
Unitate de masura |
Valori de panica |
Valori-limita de referinta |
|
|
joase |
inalte |
||
|
*Nr. Leucocite x 109/L |
<2,0 |
>20 |
4,00 11,0 |
|
*Nr.Eritrocite x 1O12/L |
<2 |
|
3,79 5,87 |
|
*Hemoglobina gm/dL |
<7 |
|
1l,7 17,7 |
|
*Hematocritul % |
< 18 |
>60 |
35,0 52,0 |
|
*VEM fL |
<65 |
> 120 |
80,5 100 |
|
HEM pg |
|
|
28,2 32,2 |
|
CHEM gm/dL |
|
|
31,7 35,7 |
|
*Nr. trombocite x109/L |
<50 |
>900 |
150450 |
|
RDW |
|
|
11,5 14,5 |
|
*Limfocite% |
|
> 70 |
20 45 |
|
*Monocite% |
|
>25 |
2,0 10 |
|
*Granulocite% |
|
|
50 75 |
|
Limfocite x 109/L |
|
|
1,5 4,5 |
|
Monocite x 109/L |
|
|
0,2 1,0 |
|
*Granulocite x 109/L |
<l,0 (pentru un Nr. L. <4,0) |
|
2,0 8,0 |
|
|
|
||
|
Eozinofile x 109/L |
|
|
0 0,7 |
|
Bazofile x 109/L |
|
|
0 0,2 |
|
* Limfocite atipice % |
|
|
05 |
|
Nesegmentate % |
|
|
0 10 |
|
*Granulocite imature (pro-, mielo-, meta-) |
|
|
|
|
|
|
00 |
|
|
* Blasti |
|
>5 |
|
|
Plasmocite % |
|
|
0 0 |
|
Eritroblasti/100 Leucocite |
|
|
0 0 |
O componenta importanta a asigurarii calitatii datelor numararii automate o prezinta revizuirea morfologiei frotiurilor de sange de catre hematolog. Cand instrumentul semnalizeaza rezultate anormale, operatorul verifica datele, iar daca anomaliile intrunesc unul sau mai multe dintre criteriile prestabilite, frotiurile sunt intinse, colorate si inaintate morfologului pentru verificare.
Tabelul XVI - Frotiuri verificate de morfolog
|
Eozinofile |
>0,7 x 109/L |
sau 20% |
|
Blasti |
Totdeauna |
|
|
Morfologia eritrocitelor - dupa caz |
|
|
|
Morfologia leucocitelor - dupa caz |
|
|
|
Aglutinare trombocitara cu alterarea numarului trombocitelor |
|
|
|
Nesegmentate > 20% daca Nr. L < 11,0 x 109/L > 30% pentru toate celelalte calcule |
|
|
|
Limfocite atipice |
≥ 5% |
|
|
Eritroblasti |
Totdeauna |
|
|
Granulocite imature |
> 5% |
|
|
Resturi celulare |
> 10% dupa albumina |
|
|
Plasmocite |
Totdeauna |
|
|
Monocite |
> 2,0 x109/L. |
|
4. Alti parametri cu relevanta clinica ai numararii complete automate. RDW si VTM reprezinta parametrii relativi noi in analiza automata. Ambele sunt relevante clinic si trebuie controlate de catre operator, iar in cazul in care se afla in afara limitelor de referinta, controlul trebuie realizat de catre patolog. S-a dovedit ca RDW face discriminari intre anemiile din deficienta nutritionala si anemiile hipoproliferative. S-au constatat valori crescute ale RDW (de >17% de exemplu) in anemia prin deficit de fier care diferentiaza aceasta anemie microcitara de talasemie. Valori ridicate ale RDW la subiectii neanemici se coreleaza cu faza initiala a carentei de fier si ar putea fi semnul cel mai precoce al acestei deficiente nutritionale. Valorile normale ale RDW apar in mod obisnuit in anemiile aplastice si in anemiile din bolile cronice. In anemiile hemolitice se inregistreaza cresterea progresiva a RDW pe eronata pe masura scaderii hemoglobinei. In conjunctie cu VEM, RDW este utila in orientarea medicului catre cauza probabila a anemiilor microcitare, normocitare si macrocitare.
Numeroase studii au aratat ca valorile VTM au relevanta clinica. Limitele utilizarii valorilor VTM deriva din faptul ca ele se modifica semnificativ in functie de timp in sangele venos, recoltat pe K3EDTA. Intrucat K3-EDTA este anticoagulantul cel mai mult folosit la analiza automata a CBC, iar timpul scurs intre colectarea sangelui si testarea propriu - zisa este variabil, astfel de modificari fac acest parametru mai putin fiabil. O alta dificultate in interpretarea valorilor VTM este aceea ca nu exista un singur nivel de referinta pentru acest parametru. O nomograma este in prezent necesara pentru a stabili daca VTM este normal sau nu in functie de numarul trombocitelor. Exista o relatie nonlineara inversa intre VTM si Nr. Tr. la subiectii normali, relatie ce se mentine si la pacientii cu purpura trombocitopenica imuna (PTI), unde numarul scazut al trombocitelor se asociaza cu valori crescute ale VTM si, de asemenea, la cazurile de trombocitoza reactiva in care numarul crescut al trombocitelor este asociat cu valori scazute ale VTM; acestea sunt tulburari sau stari in care functia maduvei osoase este normala. Aceasta relatie se modifica daca functia maduvei osoase este anormala, ca in cazul pacientilor cu trombocitopenie asociata cu o deficienta nutritionala (acid folic, Vit. B12) sau cu anemie aplastica, cand valorile VTM si ale Nr. Tr. sunt amandoua scazute. Valori crescute ale VTM se gasesc in bolile mieloproliferative, in PTI, in vasculite, post-splenectomie, in faza de refacere dupa trombocitopenie septica etc. Valori scazute ale VTM se gasesc in leucemiile acute, in anemiile aplastice, in hipersplenism, in anemiile megaloblastice si in toate trombocitozele reactive.
HDW este un nou parametru al distributiei hemoglobinei, care masoara gradul anisocromiei eritrocitelor. Se foloseste impreuna cu VEM si RDW la stabilirea diagnosticului diferential al anemiilor microcitare.
Evaluarea diferentiala automata a leucocitelor
Diferentierea globulelor albe ale sangelui a fost si ramane procedura cea mai frecvent realizata si utilizata in laboratorul clinic. Totusi utilitatea sa clinica poate fi influentata de inerentele variatii ale probei si poate fi afectata semnificativ de modul de recoltare si de prepararea acesteia; o a doua sursa a variatiei este reprezentata de diferentele inacceptabile de estimare a morfologiei celulare si de clasificare, ce apar inevitabil intre specialisiti.
Primul tip de variatii legate de probe poate fi minimalizat prin recoltarea si prepararea corecta a probelor; al doilea tip de variatii a facut ca metoda manuala de apreciere diferentiala sa fie imprecisa si inexacta. Intrucat numarul de celule examinate microscopic cu metoda manuala este mic (100 sau cel mult 200 celule), cauza principala a impreciziei o constituie alegerea eronata a esantionului pe care se face citirea. Daca o populatie de celule anormale este mica aceasta alegere eronata poate conduce in cazul diferentierii manuale, la rezultatele fals negative. Pentru a obtine prin procedura manuala un grad de precizie acceptabil (dar nu foarte ridicat totusi!) este necesar sa fie examinate; si numarate minimum 1000 celule. In practica acest lucru este imposibil; chiar si imprecisa diferentiere a 100 celule reprezinta un test costisitor realizat cu o munca intensiva.
Din necesitatea stringenta de examinare si numarare a unui mare numar de celule ce vor asigura precizia si acuratetea evaluarii diferentiale si pentru a reduce costurile si cheltuiala de timp cerute de numarul mare de analize solicitate zilnic in orice spital sau clinica, s-au dezvoltat sistemele automate de diferentiere celulara pentru analizorii utilizati in hematologia moderna.
Unii dintre analizorii initiali foloseau tehnologia imaginii digitale. Principiul se baza pe analiza imaginii digitale a unui camp microscopic, in timpul scanarii unui frotiu de sange colorat. Microscopul era conectat la o camera de televiziune si la un computer. Semnalele electronice analoage ale imaginii campului erau reduse la o serie de numere (pixeli). Componentele imaginii (nucleul, citoplasma, granulatiile etc.) erau identificate prin analiza densitatii optice si alte modificari matematice. Aceasta a reprezentat baza pentru clasificarile si numararile ulterioare de tipuri diferite de celule. Intrucat o analiza completa reproduce intregul proces de recunoastere realizat de tehnician, aceste instrumente nu erau mai bune (ci, de fapt, mai imprecise) decat un operator uman, iar numarul de celule determinate era, in mod obisnuit, tot 100 (1, 60). Intrucat nu ofereau un avantaj practic, acest tip de instrumente nu se mai produce.
1. Analizorii hematologici folositi in mod curent pentru diferentierea automata a celulelor. Principiile operative de baza au fost descrise in sectiunea care a tratat numararea completa in sange. Primele instrumente ce efectuau determinari diferentiale automate, ofereau o diferentiere in trei parti (partiala), in timp ce instrumentele curente ofera o diferentiere completa in cinci parti.
Tabel XVII - Analizori hematologici ce executa histograme diferentiale (HD)
|
Producator |
Modele |
H.D. |
|
Coulter Electronics (Hialeah, Florida, SUA) |
S-Plus IV, V, VI S-Plus STKR |
3 parametri 5 parametri cu modificari |
|
Technicon (Tarrytown, New York, SUA) |
H-l,H-2, H-3 |
5 parametri |
|
Abbot Laboratories (Santa Clara, California, SUA) |
Cell - Dyn 3000 |
5 parametri |
|
Toa (Baxter) (Mc Graw Park, Illinois, SUA) |
Sysmex NE-8000 Sysmex E-5000 Argos |
5 parametri 3 parametri 5 parametri |
|
Roche (Branchburg, New Jersey, SUA) |
Helios |
5 parametri |
Instrumentele prototip ce efectueaza o diferentiere in trei parti sunt cele din seria Coulter S-Plus. Diferentierea se obtine prin determinarea pe baza impedantei, a dimensiunii si a numarului celulelor. Se foloseste un reactiv specific care induce contractarea diferentiata a leucocitelor, astfel ca celulele care masoara 35-90 fL sunt clasificate ca limfocite, cele intre 90 si 160 fL ca monocite (in sens generic picul mononuclearelor) si cele mai mari de 160 fL ca granulocite. In cazul in care populatiile de celule analizate, nu corespund unor criterii matematice sau daca distributia lor este anormala, un operator (sau un program instrumental de alerta) devine operational, astfel ca semnale de alarma (semnale R) atrag atentia asupra prezentei unor anomalii ale populatiilor de celule (ca numar absolut sau procentual). Aceasta inseamna ca este necesara investigarea suplimentara a probelor. Histogramele indica si prezenta unor elemente anormale, cum ar fi de exemplu, celule blastice sau eritrocite nucleare. Cu toate ca, in comparatie cu metoda manuala, diferentierea automata pe 3 tipuri de celule reprezinta o imbunatatire substantiala, rezultate fals negative (5-8% din cazuri) si fals pozitive (6-48%) pot aparea in functie de tipul populatiei de pacienti. Cifrele crescute de nesegmentate neutrofile si de eozinofile sunt cauze principale ale rezultatelor fals-negative. Deoarece nu s-a demonstrat cu claritate relevanta clinica a cresterii nesegmentatelor aceasta categorie de rezultate fals-negative, are importanta minora.
Marea incidenta a rezultatelor fals pozitive are dezavantajul ca impune operatorului descifrarea cauzei si revizuirea frotiurilor, dar nu aduce prejudicii ingrijirii pacientului. Dezavantajul major al acestei analize diferentiale partiale este ca nu poate furniza informatia indispensabila despre populatiile de leucocite cu semnificatie anormala, facand-o astfel nefolositoare, mai ales la pacientii hematologici si oncologici.
In mod curent aceste modele de analizori pentru diferentierea partiala sunt utilizate doar ca instrumente de triaj pentru populatiile de pacienti care sunt normali din punct de vedere hematologic.
Aparatele Coulter care permit analiza diferentiala pe 5 parametri sunt modelele STKR si STKS. Grupele de celule sunt izolate si identificate folosind algoritmi computerizati si tehnologie VCS; cele cinci populatii de celule sunt: Li (limfocite), Mo (monocite), Eo (eozinofile), Ba (bazofile) si Ne (neutrofile). Daca populatiile de celule se suprapun sau daca apare o distribuire anormala, instrumentele emit semnale de alarma, sugerand operatorului o reverificare la microscop. Suprapunerile sau distributiile anormale sunt cauzate de prezenta unor celule cu caracteristici ce nu sunt concordante cu caracteristicile celor cinci tipuri de populatii de celule normale din sangele periferic.
Instrumentele Sysmex Ne-8000 realizeaza analiza diferentiala pe 5 parametri folosind metodologia radio-frecventei (RF) si a curentului continuu (direct ciment - DC) pentru generarea unei histograme trimodale continand populatiile de Li, Mo si Gr (granulocite). Eozinofilele si bazofilele sunt determinate separat folosind reactivi specifici de liza celulara si reglarea temperaturii.
Aparatul Cell-Dyn 3000 identifica cele 5 populatii de leucocite prin citometrie de flux cu laser de mare rezolutie. Sistemul de separare prin dispersie polarizata multiangulara identifica dimensiunea, lobularitatea granulatiile si complexitatea, iar prezenta celulelor anormale declanseaza semnalele de alarma. Sunt furnizate estimari ale procentelor de blasti, ale variantelor de limfocite, ale granulocitelor imature si nesegmentate; asemenea specimene necesita verificarea frotiului.
Instrumentul Cobas Argos 5-Diff ofera o analiza diferentiala pe 5 parametri bazat pe impedanta, marcare citochimica si absorbanta optica. Esantionul de sange este tratat cu un reactiv ce lizeaza eritrocitele, stabilizeaza globulele albe si marcheaza specific eozinofilele. Bazofilele sunt determinate intr-un canal separat, folosind un reactiv litic ce distruge membrana celulara a tuturor tipurilor de leucocite cu exceptia bazofilelor, dupa care numararea lor se face prin impedanta.
Aparatele Technicon H-l, H-2, H-3 asigura evaluarea numerica complet si analiza diferentiala in cinci parti si recent (sistemul H-3) si determinari de reticulocite. Diferentierea se obtine pe baza tehnologiei citometriei de flux si a citochimiei peroxidazei. Canalul peroxidazei (Perox) clasifica globulele albe pe baza marimii celulei si a activitatii mieloperoxidaze: sunt determinate valorile absolute si procentuale pentru neutrofile, limfocite, monocite, eozinofile si celule mari nemarcate (LUC=large unstained cells). Daca acestea din urma sunt ≥4%, rezultatele sunt semnalizate. Un al doilea canal este pentru bazofile/lobularitate (BL); in acest canal sunt descompuse eritrocitele si leucocitele cu exceptia bazofilelor ce sunt rezistente la reactivul de liza. Blastii sunt separati de celulele mononucleare dupa un prag prestabilit, iar in cazul in care procentul lor depaseste 5% apare semnalizarea.
Rezultatele ambelor canale, Perox si BL sunt integrate sub forma expunerii diferentiale a celor 5 parametri.
2. Reverificarea rezultatelor analizei diferentiale. Pentru conditiile clinice s-au comunicat diferite cai pentru efectuarea analizei numerice si diferentiale. O cale este aceea de a realiza o analiza completa dublata de reverificarea morfologica a tuturor pacientilor in momentul internarii lor. Ulterior, in monitorizarea pacientului se va folosi numai analiza automata, iar verificarea morfologiei se va face numai asupra acelor specimene la care se modifica unul sau doi din parametrii unei valori specificate. Aceasta procedura implica cel putin o verificare morfologica pentru fiecare pacient si o monitorizare continua pe parcursul spitalizarii pentru detectarea schimbarilor semnificative.
O alta cale este aceea de a face analiza diferentiala si examinarea morfologica numai la specimenele cu o analiza numerica automata anormala, in cazul in care anormalitatea corespunde unor criterii stabilite in prealabil.
Orice laborator trebuie sa-si stabileasca criterii de triaj pentru acceptarea determinarilor diferentiale automate sau pentru efectuarea verificarii manuale si a evaluarii morfologiei; aceste criterii depind de populatia de pacienti si de tipul si instrumentul folosit. Semnalele de anormalitate/revizie si aspectul histogramelor vor fi diferite in functie de analizori si de tehnologia proprie a acestora. Fiecare producator prevede un set de criterii fixe; in plus fata de acestea, operatorii pot stabili limite si game pentru ca rezultatele plasate in afara acestora sa genereze semnale de alarma. Sensibilitatea sistemului de semnalizare trebuie calculata in asa fel, incat sa determine proportia de rezultate fals-negative si fals-pozitive. Ideal ar fi ca proportia rezultatelor fals-negative sa fie de 2-4%. Rezultatele fals-pozitive depind in mare masura de cat de precaut trebuie sa fie laboratorul; in general cifrele se cuprind intre 8 si 15%. Diferentele se explica prin faptul ca obiectivul principal al analizei automate (ca si al celei manuale) este detectarea anomaliilor, deci de a reduce la minimum rezultatele fals-negative ce pot aduce prejudicii ingrijirii pacientului. Pe de alta parte datele fals-pozitive semnalizate de instrument in absenta unor anomalii semnificative, vor impune o simpla verificare a lor si, in unele cazuri, o examinare a frotiurilor, dar nu vor avea efecte negative asupra ingrijirii pacientului, deoarece rezultatele vor fi corectate la timp, inainte de a fi raportate.
![]() Toate
laboratoarele moderne dispun de un sistem computerizat, fie independent (LIS) (LIS=Laboratory independent sistem), fie
conectat la reteaua computerizata a spitalului (HCS) (HCS=hospital computer system). In practica curenta
analizorii automati sunt interfazati cu computerul laboratorului sau
cu reteaua spitalului, iar
sistemul este prevazut cu un set de
criterii pentru semnalizarea modificarilor care apar intre testari succesive. Daca aceste modificari
sunt mai mari decat anumite limite stabilite in functie de variatia testului, computerul va semnaliza aceste diferente
si le va compara cu determinarile prealabile (verificari delta). Un specimen ce
nu corespunde acestor verificari va fi reanalizat (datele
numararii si analizei diferentiale automate vor fi
revazute de catre operator, si daca este cazul, evaluarea
morfologica si datele clinice vor fi controlate de catre
morfolog). Se inregistreaza frecvent si situatii in care
analizele diferentiale automate se
afla in limitele normale (de referinta) sau situatii in care parametrii stabiliti sunt admisi la verificare, dar
se insotesc de histograme anormale.
In asemenea cazuri, este necesara verificarea frotiului si se
poate cere efectuarea unei hemograme
manuale in functie de constatari.
Toate
laboratoarele moderne dispun de un sistem computerizat, fie independent (LIS) (LIS=Laboratory independent sistem), fie
conectat la reteaua computerizata a spitalului (HCS) (HCS=hospital computer system). In practica curenta
analizorii automati sunt interfazati cu computerul laboratorului sau
cu reteaua spitalului, iar
sistemul este prevazut cu un set de
criterii pentru semnalizarea modificarilor care apar intre testari succesive. Daca aceste modificari
sunt mai mari decat anumite limite stabilite in functie de variatia testului, computerul va semnaliza aceste diferente
si le va compara cu determinarile prealabile (verificari delta). Un specimen ce
nu corespunde acestor verificari va fi reanalizat (datele
numararii si analizei diferentiale automate vor fi
revazute de catre operator, si daca este cazul, evaluarea
morfologica si datele clinice vor fi controlate de catre
morfolog). Se inregistreaza frecvent si situatii in care
analizele diferentiale automate se
afla in limitele normale (de referinta) sau situatii in care parametrii stabiliti sunt admisi la verificare, dar
se insotesc de histograme anormale.
In asemenea cazuri, este necesara verificarea frotiului si se
poate cere efectuarea unei hemograme
manuale in functie de constatari.
Un alt avantaj al diferentierii automate este acela ca pe langa valorile procentuale, sunt consemnate si valorile absolute pentru diferitele tipuri de celule de sangele periferic, in timp ce hemogramele manuale aditionale ofera numai valorile relative. Pentru clinicieni si morfologi este important sa gandeasca in primul rand in termenii numerelor absolute, intrucat valorile procentuale sunt in mod esential relative si pot conduce la greseli prin mascarea unei anomalii reale.
Chiar si intr-un laborator mic, care nu dispune de analizor automat, cifrele absolute trebuie calculate manual din numarul total de leucocite si din procentul tipurilor de celule si apoi comunicate. Aceasta practica va evita o interpretare potential eronata a valorilor procentuale ca in exemplul de mai jos: un barbat de 61 ani prezinta un numar de leucocite de 3x109/L si o formula leucocitara cu 90% limfocite si 10% neutrofile. In mod superficial un medic fara experienta va interpreta acest aspect drept limfocitoza. De fapt problema acestui caz nu este limfocitoza, deoarece in valoare absoluta (3xl09/Lx0,90=2,7xl09/L) limfocitele sunt in limite normale. In realitate exista o descrestere a numarului absolut de neutrofile, conform calculului (3xl09/Lx0,10=0,3xl09/L) care arata clar o neutropenie absoluta severa. Desigur numararile absolute calculate din determinarile manuale sunt mult mai putin precise decat cele furnizate de instrumentele automate, care se bazeaza pe analiza unor largi populatii de celule. Numararile absolute trebuie sa fie folosite in evaluarea si monitorizarea pacientului; educarea in acest sens a oamenilor de laborator si a medicilor este esentiala.
Pe langa numararile fiabile (absolute si relative) de celule si a indicilor celulari, analizoarele moderne furnizeaza si o suma de alte informatii. Aspectele grafice ale histogramelor diferentiale pot conduce operatorul spre un anume diagnostic. Leucemia poate fi nu numai suspectata, ci uneori si caracterizata drept limfoida sau nonlimfoida; in mod cert aceasta apreciere nu se va substitui examenului morfologic al frotiurilor sau studiilor speciale, dar asemenea sugestii sunt foarte folositoare operatorului pentru initierea studiilor aditionale corespunzatoare. In unele cazuri progresiunea leucemiei poate fi monitorizata dupa aspectul histogramei (scatergrama sau citograma). De exemplu, progresiunea leucemiei granulocitare cronice catre transformarea blastica sau transformarea prolimfocitoida a leucemiei limfocitare cronice pot fi detectate din modificarile imaginilor histogramei. Determinarile diferentiale automate sunt foarte utile in cazurile cu leucopenie; in asemenea cazuri, analizele manuale sunt dificile si inexacte din cauza numarului mic de celule.
Analizorii automati ofera indicatii folositoare asupra devierii la stanga a neutrofilelor (fig. 12). Analizorii automati pot detecta chiar un numar mic de celule blastice circulante dintre numeroasele elemente celulare analizate; astfel de numere mici de celule blastice ar putea fi nesesizate la analiza manuala. Un alt avantaj al utilizarii analizorilor automati este monitorizarea refacerii maduvei osoase dupa chimioterapia ablativa.
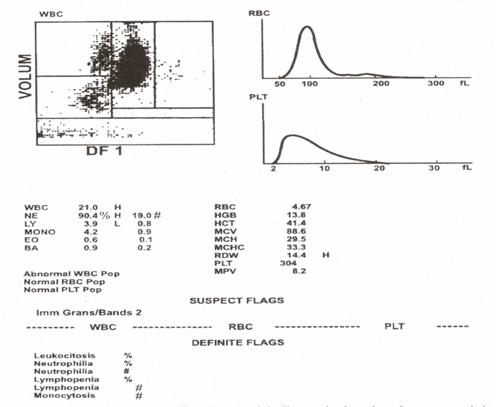
Fig.12 - Analiza pe Coulter STKS. Aspectul indica o deviere la stanga cu activitate marita in portiunea superioara a casetei neutrofilelor. In sangele periferic s-au gasit nesegmentate, metamielocite si un mielocit izolat
(reproducere dupa Krause JT, cu permisiune).
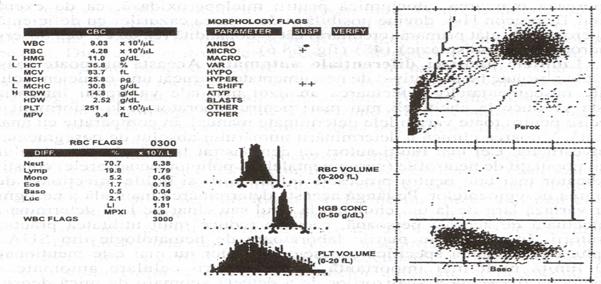
Fig.13 - Analiza pe Tehnicon H-l. Si acesta este un model de deviere la stanga indicat de un index de lobularitate (LI) scazut, de 1,81 (raportul intre polimorfonucleare si celulele mononucleare) si de un semnal "left shift' ++, provocat de nesegmentate, metamielocite si mielocite (reproducere dupa Krause JR, cu permisiune).
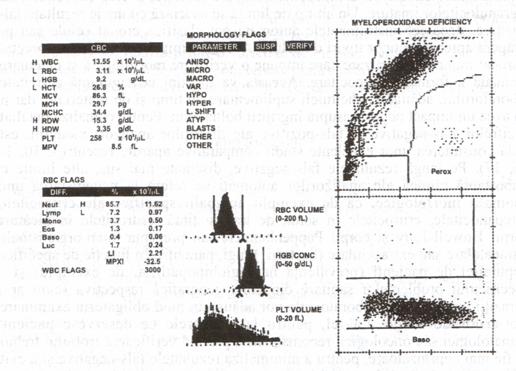
Fig. 14 - Analiza pe Tehnicon H-l. Acesta este un caz de diferenta dobandita de mieloperoxidaza (MPXI=-32,5). Absenta peroxidazei produce in canalul. Perox. o deplasare la stanga a polisegmentatelor catre zona monocitelor. Cu toate acestea, la analiza cu laser (canalul bazofilelor) celulele apar ca polisegmentate. Pacientul are o boala mielodisplazica (reproducere dupa Krause JR, cu permisiune).
In cazul analizorilor ce incorporeaza marcarea citochimica pentru mieloperoxidaza, ca de exemplu sistemul Technicon H-l, devine posibila si detectarea cazurilor cu deficienta de mieloperoxidaza, atat primara (ereditara) cat si dobandita.
3. Limitele analizei diferentiale automate. Aceasta nu poate masura cantitatile absolute (sau relative) de nesegmentate. Intrucat unii clinicieni solicita valorile nesegmentatelor, efectuarea analizei manuale va trebui intreprinsa. Aceasta va duce la cheltuieli mai mari pentru laborator si la informatii mai imprecise pentru toate variabilele determinate manual, in comparatie cu analiza automata. Valoarea clinica a determinarii numarului absolut de nesegmentate a fost investigata. Cei mai multi autori au demonstrat faptul ca cifra absoluta a intregii populatii de neutrofile (nesegmentalele si polimorfonuclearele) constituie un indicator mai bun pentru procesele inflamatorii si bolile infectioase decat numararea nesegmentelor. Pe langa aceasta determinarea manuala a nesegmentatelor variaza larg de la un tehnician la altul sau chiar de la o determinare la alta efectuata de aceeasi persoana, ceea ce reduce mult utilitatea practica a masuratorii. In multe din marile laboratoare de hematologie din SUA, de exemplu, determinarea specifica a nesegmentatelor nu mai este mentionata.
O limita mult mai importanta a diferentierii celulare automate este incapacitatea frecventa a analizorilor de a detecta anomalii de mica densitate, dar care ar putea avea semnificatie clinica. Asemenea ratari, corespund procentului de rezultate fals negative date de un anumit instrument. Exemple de rezultate fals-negative sunt: prezenta eritroblastilor, a limfoblastilor, a celulelor limfomatoase circulante, a limfocitelor atipice reactive, a tricoleucocitelor sau a granulocitelor imature. Un alt tip de limita se asociaza cu unele rezultate fals-pozitive, deoarece instrumentele automate pot clasifica eronat celule sau pot exagera aprecierea unor tipuri de celule. Aceasta limita este de obicei corectata intrucat induce o avertizare care impune o verificare morfologica si efectuarea manuala a formulei leucocitare. Aceasta va incetini cu siguranta activitatea laboratorului, adaugand cheltuieli suplimentare de timp si de materiale, dar nu va avea un impact negativ asupra ingrijirii bolnavului. Pentru o analiza detaliata a cifrelor fals-negative si fals-pozitive ale diferitilor analizori moderni,este utila consultarea unor excelente studii comparative aparute recent. Pe langa rezultatele fals-negative, discutate mai sus, alte limite cu importanta clinica ale analizorilor automati se refera la nedepistarea unor anomalii morfologice, ca de exemplu anomalii specifice ale eritrocitelor (drepanocitele, eritrocitele in semn de tras la tinta, eritrocitele in picatura, corpii Howell-Jolly si corpii Pappenheimer) sau prezenta microorganismelor intracelulare sau extracelulare (bacterii, fungi, paraziti). In functie de specificul populatiei de pacienti (prevalenta hemoglobinopatiilor, de exemplu) si al specificului problemelor sanitare din zona geografica respectiva (cum ar fi parazitii eritrocitelor), laboratoarele vor adauga in mod obligatoriu examinarea frotiurilor de sange. La fel, pentru laboratoarele ce deservesc pacientii hematologici sau oncologici, recomandarile privind verificarea frotiului trebuie sa fie mai cuprinzatoare, pentru a minimaliza rezultatele fals-negative si a evita nedetectarea anomaliilor morfologice mai sus mentionate.
![]()
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








