
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Cosmeceutice colagenoformatoare - rolul speciei Oenothera biennis |
Cosmeceutice colagenoformatoare - rolul speciei Oenothera biennis
Cosmeceutice colagenoformatoare - rolul speciei Oenothera biennis
1.1. Ultrastructura colagenilor umani
Colagenul este un biopolimer care in vivo detine o functie structurala bazata tocmai pe interactiile ce se creaza pentru mentinerea celulelor in tesuturi, disponibile interactiei cu diferite substante biologic active: hormoni, enzime, peptide, etc. Accesibilitatea acestora la situsurile de legare ale colagenului este facilitata de extraordinara capacitate hidrofila a acestuia. La pH neutru el poate adsorbi apa la un nivel de 100% din greutatea sa uscata si pana la 500% la valori de pH extreme, foarte acide sau foarte bazice [21].
Capacitatea mare de gonflare a colagenului asigura un regim hidrodinamic optim al interactiei acestuia cu o enzima, prin micsorarea rezistentei interioare la transport in difuzia substratului si produsilor rezultati. Natura proteica a colagenului contribuie prin resturile de aminoacizi polari si nepolari la interactii puternice, noncovalente, cu molecule biologice.
1.1. Caracteristici generale ale colagenilor
Pana nu demult, colagenii erau definiti ca molecule ale matricei extracelulare (MEC) ce contin domenii de secvente repetitive -Gly - X - Y-, unde X si Y reprezinta orice aminoacid care se pliaza intr-o structura unica triplu helicala.. Studii ulterioare au evidentiat un numar mare de proteine inrudite, cu lungimi variabile ale domeniului triplu helical, intrerupte adesea de domenii necolagenice prezente atat in MEC cat si in membranele celulare [21, 22].
La vertebrate, au fost puse in evidenta pana in prezent 20 de tipuri de colagen si cel putin inca 10 proteine care prezinta domenii asemanatoare colagenilor, fara ca prin aceasta sa fie acoperita intreaga gama potentiala.
Aceste tipuri se intalnesc in modele unice, specifice unui tesut, apar in timpul dezvoltarii in modele temporale si spatiale specifice si prezinta proprietati functionale diferite. De asemenea, sunt implicate, direct sau indirect, in atasarea si diferentierea celulelor precum si in procese imunologice, astfel ca, in afara rolului sau structural, colagenul participa la procese complexe cum ar fi: dezvoltarea, morfogeneza si procesele patologice. Varietatea tipurilor de colagen nu este insa rezultatul exclusiv al diferentelor de structura la nivel molecular, ea aparand si ca rezultat al activitatii celulare in procesul de asamblare a moleculelor in structurile supramoleculare.
1.2. Structura si functiile moleculei de colagen
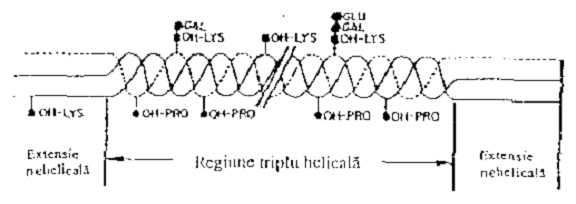
Din punct de vedere compozitional, trasaturile principale ale colagenilor sunt: proportia considerabila in care se gaseste glicina (Gly) (30-40%) si iminoacizii prolina (Pro) si hidroxiprolina (Hyp) (25-35%); aparitia formelor hidroxilate ale prolinei si lizinei (Lys) -Hyp si Hyl (hidroxilizina); glicozilarea variabila a anumitor resturi de Hyl cu glucoza (Glu) si galactoza (Gal) in variantele Hyl-Gal ]i Hyl-Gal-Glu.
La majoritatea tipurilor de colagen o portiune insemnata a structurii primare este de tipul -(Gly-X-Y)n-, cu un continut mare de iminoacizi in pozitiile X si Y. La vertebrate, colagenii fibrilari (interstitiali) prezinta o astfel de secventa repetitiva de 330-340 de ori consecutiva. Aceasta secventa este prelungita de o parte si de alta de extensii scurte care nu se repeta, numite telopeptide sau propeptide terminale.
In regiunea in care structura primara a lanturilor individuale este de tipul - (Gly-X-Y)n -, molecula adopta o forma triplu helicala specifica, pusa in evidenta in urma unor studii de raze X, dicroism circular si spectroscopie IR. Fiecare lant, denumit si alfa, este rasucit spre stanga, iar cele trei lanturi se rasucesc intr-o tripla elice (triplu helix), rasucita spre dreapta. O astfel de organizare necesita prezenta Gly in fiecare a treia pozitie a lantului. Gly este singurul aminoacid ce se poate acomoda in pozitiile interne ale triplului helix datorita radicalului sau de hidrogen, ce are dimensiuni minime. De asemenea, formarea triplului helix este favorizata de prezenta Pro si Hyp in pozitiile X si Y, care datorita rigiditatii inelelor pirolidinice impun restrictii asupra rotatiei lanturilor [22, 23].
Conformatia de triplu helix este stabilizata si de prezenta legaturilor de hidrogen intre lanturile constituente, care implica participarea moleculelor de apa si a gruparilor hidroxil ale Hyp.
In general, forma si majoritatea proprietatilor structurale ale moleculei de colagen sunt determinate de domeniul sau de triplu helix, care la tipurile de colagen fibrilar constituie 95% din marimea moleculei. Aceste domenii pot indeplini doua functii importante: (a) in primul rand, ele pot actiona ca niste catene moleculare care separa domenii functionale si (b) in al doilea rand, ele se agrega lateral pentru a forma ansambluri supramoleculare, ce asigura rezistenta mecanica tesuturilor conjunctive.
Variatiile in structura macromoleculara a colagenilor, datorate diferentelor privind secventa de aminoacizi, gradelor de glicozilare sau modificarilor posttranslationale duc la schimbari ale proprietatilor lor biomecanice. La tipurile de colagen care au mai multe domenii triplu helicale, telopeptidele depasesc uneori, ca masa si volum, regiunea de triplu helix, ceea ce confera moleculei o flexibilitate mult mai mare in raport cu cea a colagenilor fibrilari.
1.Clasificarea colagenilor
In sistemul de nomenclatura pentru colageni, fiecare din cele 20 de tipuri cunoscute au primit un numar, care reflecta, in general, ordinea cronologica in care acestea au fost descoperite (de exemplu, tip I, tip II, etc).
Notarea completa a moleculei de colagen include lanturile constituente, denumite lanturi alfa, tipul de colagen caruia ii apartin aceste lanturi, precum si raportul in care aceste lanturi se gasesc in compozitia moleculei. Astfel ca, cele trei lanturi asociate intr-o molecula sunt fie genetic identice, ca in cazul tipului II sau tipului III, fie apartinand la doua clase genetic distincte.
Tipurile de colagen au fost grupate in sapte clase distincte, in functie de caracteristicile structurale asemanatoare si de structurile polimerice pe care acestia le formeaza (fig 10) [24, 25].
Dintre acestea, tipurile I, II, III, V si IX formeaza clasa colagenilor fibrilari (A).
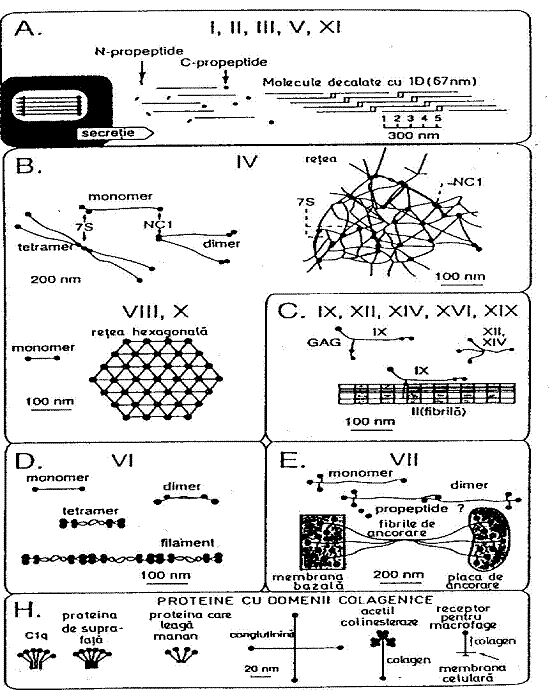
Fig 10 - Reprezentarea schematica a structurii diferitilor colageni.
A - colagenii fibrilari; B - colagenii care formeaza rtele; C - colagenii asociati fibrilelor;
D - colagenii microfibrilari; E - colagenii care formeaza fibrile de ancorare; H - proteine necolagenice cu domenii triplu helicale.
Proprietatea lor fundamentala este aceea de a se asocia in fibrile ce constituie unitatea de baza in principalele organe si tesuturi (derm, tendon, cartilagiu, os, plaman).
Intr-o clasa separata (B) au fost grupate tipurile de colagen IV, VIII si X care formeaza retele ca in membranele bazale, iar tipurile IX, XIV, XVI, XVII, XIX formeaza clasa colagenilor asociati fibrilelor, denumiti si colagenii FACIT (Fibril Associated Collagens with Interrupted Triple Helices - clasa C de colageni) [26].
Celelalte tipuri de colagen, fie ca se asociaza sub forma de filamente (tipul VI) (clasa D) sau formeaza fibrele de ancorare (tipul VII) (clasa E); fie ca prezinta un domeniu transmembranar (tipurile XIII si XVII) (clasa F) sau sunt partial caracterizati (tipurile XV, XVIII si XX) (clasa G). In plus, in fig 7 sunt prezentate si o serie de proteine care prezinta domenii triplu helicale dar care nu au fost definite drept colageni (clasa H).
Aceasta clasa include componenta C1q a complementului, enzima acetil-colinesteraza, proteinele de suprafata pulmonara SP-A si SP-D, proteine care leaga mananul, conglutinina, receptorii macrofagelor tip I si tip II.
Colagenii fibrilari
Tipul I de colagen este cel mai abundent, reprezentand circa 80% din totalul colagenilor tesuturilor conjunctive. El a fost prototipul de colagen, pe baza caruia s-au obtinut cele mai multe informatii legate de structura acestor proteine.
|
Fig 11 - Reprezentarea schematica a moleculei de colagen tip I.
Molecula are o lungime de aproximativ 300 nm si consta din trei lanturi alfa asamblate intr-o structura helicala care se extinde la ambele capete cu peptide nehelicale (extensia NH2-terminala si COOH-terminala) (fig 8). Aceasta este un heteropolimer in care cele doua lanturi alfa1(I) si alfa 2(I) sunt sintetizate de gene diferite si au aproximativ 1025 aminoacizi fiecare. Lanturile nu contin cisteina, iar aminoacizii aromatici sunt in cantitati foarte mici.
Tipul II, component al cartilajului si al stromei corneene primare este un homotrimer al lantului alfa1(II). Desi lanturile alfa1(I) si alfa1(II) au marimi similare, ele sunt produse de gene diferite. Caracteristicile structurale ale tipului II sunt asemanatoare cu tipul I cu deosebirea ca cele mai multe resturi de Lys din structura lantului alfa1(II) sunt convertite la Hyl, iar multe dintre acestea din urma sunt glicozilate.
Tipul III este intalnit in multe tesuturi printre care dermul si apare frecvent in fibrile heterotipice alaturi de colagenul I. Molecula nativa este un homotrimer compus dintr-un singur tip de lant - alfa1(III). Aceasta se caracterizeaza din punct de vedere compozitional prin: continut ridicat in Hyp; mai mult de 333 resturi de Gly pe un lant; formarea legaturilor disulfidice in regiunea helicala, datorita prezentei cisteinei.
Organizarea supramoleculara si distributia tisulara a acestui tip de colagen nu sunt pe deplin elucidate. Se presupune ca prezenta unui numar mai mare de resturi de Gly determina instabilitatea moleculei, putandu-se astfel explica existenta unui turnover mai rapid la matricile care contin acest tip de colagen.
Tipul V se antalneste alaturi de tipul I de colagen sub forma de fibrile heterotipice, in care ambele tipuri isi pastreaza modelul de bandare tipic colagenilor fibrilari. Structura moleculei de colagen tip V este diferita de cea a celorlalti colageni fibrilari avand o forma asemanatoare moleculelor de procolagen partial prelucrate. De aceea, procesarea procolagenului tip V este mai complexa, cu o durata mai mare decat a celorlalti colageni fibrilari. De fapt, tipul V de colagen este reprezentat de o clasa de molecule inrudite dar distincte. Formula moleculara predominanta, intalnita la multe tesuturi este un heterotrimer.
Colagenii microfibrilari
Tipul VI face parte din clasa colagenilor microfibrilari care au ca principala caracteristica formarea de retele filamentoase, in care fibrile fine, nestriate se asociaza slab. Cunoscut initial sub numele de colagen intima, colagenul tip VI a devenit obiectul de studiu al multor cercetari de biologie celulara datorita, in principal, organizarii sale unice sub forma de filamente, identificarii sale cu glicoproteina GP 140 si a gradului ridicat de imunogenitate. Se gasate in majoritatea tesuturilor conjunctive stromale, in cornee fiind prezent in cantitati reduse.
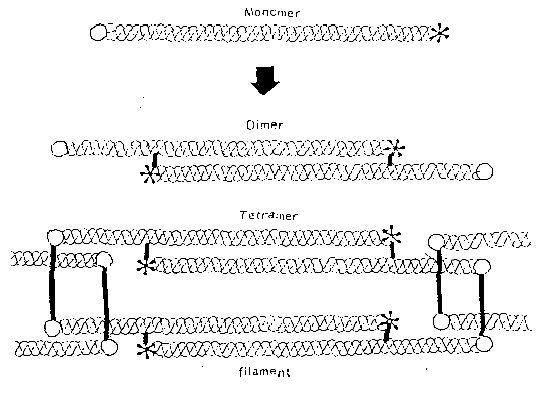
Fig 12 - Model de asamblare supramolecula a colagenului tip VI.
Monomerii sunt asociti in dimeri si tetrameri. Cercurile si asterixurile reprezinta cele doua capete ale moleculei, iar liniile verticale indica legaturile disulfidice
Analizele biochimice au demonstrat ca molecula de colagen tip VI este compusa din trei lanturi diferite [alfa1(VI) alfa2(VI) alfa3(VI)], cu o greutate moleculara de 110-140 kDa fiecare. Lanturile sunt compuse dintr-un domeniu central helical de 105 nm si cate un domeniu globular mare la fiecare capat. Asamblarea supramoleculara a moleculei de colagen tip VI in structurile filamentoase implica formarea dimerilor (in care doua molecule sunt aranjate longitudinal una fata de alta), a tetramerilor (in care doi dimeri se asociaza lateral) si asocierea liniara a acestora in structuri microfibrilare perlate.
Cercetarile ultimilor ani au stabilit similaritati structurale intre colagenul tip VI si glicoproteina de suprafata celulara - GP 140 prin prezenta a cel putin 11 secvente RGD (Arg-Gly-Asp), atat in domeniul triplu elicoidal cat si in regiunile globulare.
Colageni asociati fibrilelor (FACIT)
Colagenii FACIT nu formeaza fibrile dar sunt atasati la suprafata acestora. Din punct de vedere structural, ei prezinta domenii triplu-helicale scurte, intrerupte de secvente necolagenice.
Tipul IX, cel mai studiat colagen FACIT se gaseste din abundenta la suprafata fibrilelor de tip II in tesuturile cartilaginoase. De asemenea, el este o componenta importanta a stromei corneene primare, a notocordului si corpului vitros. Molecula de colagen tip IX este un heterotrimer cu trei domenii colagenice (COL 1-3) si patru domenii necolagenice (NC 1-4) (fig 13).
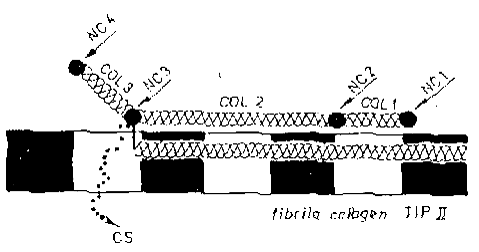
Fig 13 - Structura moleculei de colagen tip IX.
Domeniile COL 1-3 reprezinta domeniile colagenice, iar NC 1-4 domeniile necolagenice. Linia punctata indica lantul de condroitin sulfat, iar linia verticala dintre NC 3 si moleculatipului II reprezinta o legatura disulfidica
Structural, colagenul tip IX pare potrivit pentru interactii simultane cu fibrile de colagen si alte componente matriceale. De-a lungul suprafetei fibrilelor de colagen, moleculele tipului IX sunt aranjate specific, astfel ca anumite domenii (NC 1 pana la COL 2) sunt paralele cu fibrilele striate, iar celelalte domenii (COL 3 si NC 4) sunt dispuse spre exteriorul fibrilelor. La domeniul NC 3 se leaga covalent un lant lung de condroitin sulfat (CS) sau dermatan sulfat (DS), ceea ce da unicitate tipului IX de colagen, putand fi considerat un proteoglican. Studii pe stroma corneana primara au relevat diferente structurale ale tipului IX din acest tesut fata de cel din cartilagii. Astfel ca domeniul NC 4 este mai mic in stroma corneana primara si, se pare ca, are proprietati diferite [26].
1.4. Biosinteza colagenilor
Colagenii se sintetizeaza intracelular (intrafibroblastic), sub forma unor molecule precursoare mari, solubile, denumite procolageni in care fiecare lant prezinta in regiunile terminale peptide de extensie aditionale-propeptide (fig 14) [27].
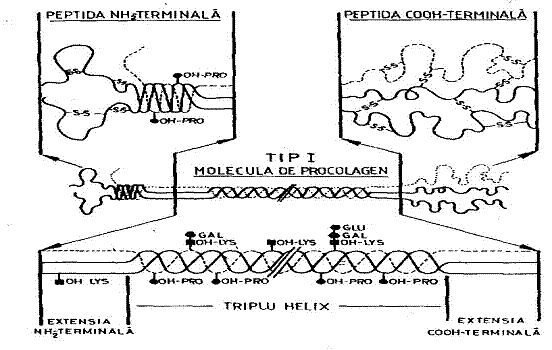
Fig 14 - Reprezentarea schematica a moleculelor de colagen si procolagen tip I
Dupa secretia procolagenilor in spatiul extracelular, propeptidele sunt indepartate prin actiunea unor procolagen metaloproteinaze. Moleculele care rezulta se autoasambleaza spontan in imediata vecinatate a fibroblastelor pentru a forma fibrile. La nivele superioare, fibrilele se pot organiza in fibre, care pot fi dispuse in forme extrem de complexe.
Sinteza moleculelor de colageni fibrilari si asamblarea extracelulara a acestora,
prezentate in figura 15, cuprind urmatoarele etape [44]:
A. Etapele intracelulare :
- sinteza lanturilor polipeptidice (lanturi pro-alfa);
- hidroxilarea unor resturi de Pro si Lys;
- glicozilarea unor resturi de Hyl;
- aditia unui oligozaharid bogat in manoza (Man);
- formarea moleculei de procolagen si secretia sa in spatiul extracelular.
B. Etapele extracelulare :
- procesarea procolagenului in colagen;
- asamblarea moleculelor de colagen in fibrile;
- formarea fibrei de colagen.
Pentru colagenii nefibrilari, biosinteza se realizeaza dupa aceleasi etape ca la cei fibrilari existand insa diferente notabile privind procesarea procolagenilor. Multi colageni nefibrilari contin propeptidele NH2- si COOH-terminale neprocesate, iar colagenii FACIT prezinta situsuri de atasare pentru glicozaminoglicani.
Etapele intracelulare
Lanturile polipeptidice individuale sunt sintetizate la nivelul ribozomilor asociati reticulului endoplasmic (RE) sub forma de lanturi pro-alfa. Sinteza lor se realizeaza prin aceleasi etape prin care se biosintetizeaza toate proteinele. Etapele care urmeaza sunt insa specifice proteinei colagen. In lumenul RE, are loc hidroxilarea unor resturi de Pro si Lys de la nivelul polipeptidelor formand Hyp si Hyl. La tipurile de colageni fibrilari aproape jumatate din resturile de Pro sunt convertite enzimatic in Hyp. Enzima responsabila de hidroxilare - prolilhidroxilaza, actioneaza in prezenta oxigenului molecular, a alfa- cetoglutaratului, a Fe2+ si a acidului ascorbic. Intr-o proportie mai mica, resturile de Lys din lantul in formare pot suferi reactia de hidroxilare in prezenta enzimei lizilhidroxilaza.
Unele resturi de Hyl pot fi, in continuare, glicozilate prin actiunea secventiala a doua enzime: galactozil-transferaza si glucozil-transferaza.
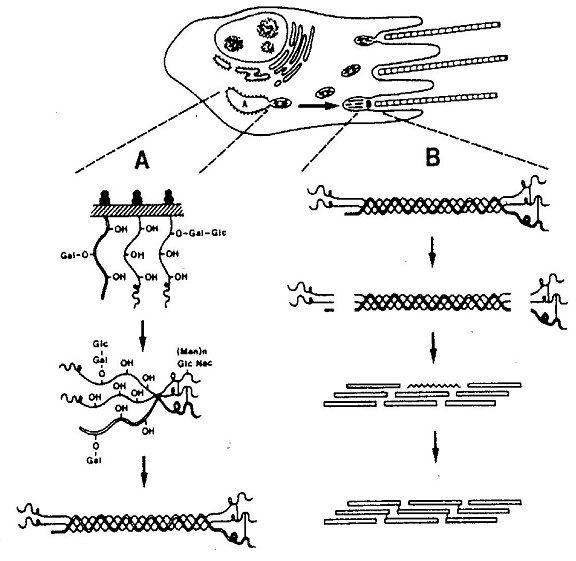
Fig 15 - Reprezentarea schematica a principalelor etape ale biosintezei colagenilor fibrilari.
A. Etapele intracelulare implica hidroxilari si glicozilari post-translationale, asocierea
lanturilor polipeptidice si formarea triplului helix.
B. Etapele extracelulare constau in clivarea propeptidelor terminale, autoasamblarea colagenilor in fibrile si formarea legaturilor covalente intre fibrile
Glicozilarea poate avea loc si la nivelul propeptidelor COOH-terminale ale procolagenului prin transferul unui lant oligozaharidic bogat in Man de la un intermediar dolicol-fosfat la un rest de asparagina din lantul polipeptidic. Fiecare lant pro-alfa astfel sintetizat si procesat se combina apoi cu alte doua pentru a forma molecula triplu helicala, stabilizata prin legaturi de hidrogen, cunoscuta sub denumirea de procolagen. Studii anterioare au demonstrat ca asocierea celor trei lanturi polipeptidice incepe la nivelul propeptidelor COOH-terminale, prin intermediul puntilor disulfidice intercatenare formate de resturile de cisteina. Secretia procolagenului in spatiul extracelular implica transportul de la RE la complexul Golgi si apoi translocarea procolagenului la veziculele secretorii.
Etapele extracelulare
Procesarea procolagenului in spatiul extracelular are loc prin acttiunea a doua metaloproteinaze cunoscute sub denumirea de procolagen-peptidaze (NH2- si COOH-peptidaze). Moleculele de colagen rezultate, cunoscute si sub numele de tropocolageni, se autoasambleaza pentru a forma fibrile, proces ce are loc in apropierea membranei plasmatice a fibroblastului. Cel mai acceptat model al impachetarii moleculelor de colagen in fibrile, evidentiat prin microscopie electronica (ME), este cel reprezentat in figura 16.
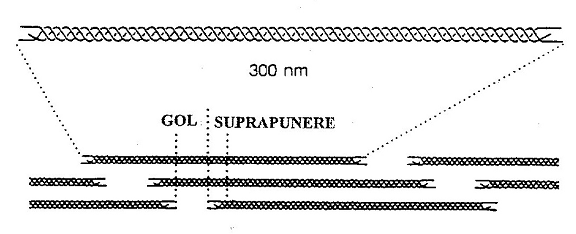
Fig 16 - Dispunerea moleculelor de colagen in interiorul unei fibrile
Moleculele sunt dispuse in siruri axiale paralele, iar doua siruri vecine sunt decalate intre ele la un sfert din lungimea moleculei. Intre capatul NH2-terminal al unei molecule si cel COOH-terminal al urmatoarei molecule se creeaza un mic spatiu-zona de gol, care in ME folosind coloratia negativa apare ca o banda intunecata. Spatiul in care suprapunerea moleculara este completa este cunoscut sub numele de zona de suprapunere si apare in ME ca banda luminata. Unitatea repetitiva de baza notata cu D, unde 1D=67nm, consta din zona de gol (0,6D) si zona de suprapunere (0,4D).
Etapa finala a fibrilogenezei consta in stabilizarea fibrilei prin legaturi covalente incrucisate intra- si inter-moleculare. Compusii chimici implicati in formarea acestor legaturi sunt derivati aldehidici ai Lys si Hyl - allizina si, respectiv, hidroxiallizina, rezultati in urma actiunii enzimei liziloxidaza.
Linsenmayer a aratat ca prezenta zonelor de gol este necesara procesului de reticulare pentru ca liziloxidaza sa poata difuza iin interiorul fibrilelor si actiona asupra substratului sau. Condensarea aldehidelor din regiunea de triplu helix a unei molecule cu resturile de Lys din regiunea terminala a unei molecule adiacente conduce la formarea bazelor Schiff corespunzatoare. Computii astfel formati, pot suferi o reactie interna de oxido-reducere, dand nastere unei legaturi ceto-imidice stabile. Numarul si tipul legaturilor covalente variaza cu functia fiziologica si varsta tesutului.
1.5. Asamblarea colagenilor
Fibrila de colagen este unitatea functionala majora a tesuturilor conjunctive, care se formeaza printr-un proces de morfogeneza moleculara denumit fibrilogeneza. In acest proces moleculele de colagen sau precursorii lor procolagenici se asambleaza in structuri supramoleculare avand diametre si lungimi proprii. Asamblarea colagenului in fibrile este controlata celular si se considera ca este influentata de urmatorii factori:
(a) tendinta de autoasociere laterala a moleculelor de colagen. Secventa de aminoacizi a colagenului dicteaza multe din proprietatile de asamblare a moleculelor de colagen deoarece s-a determinat ca unele portiuni din structura primara sunt responsabile de formarea fibrilelor cu anumite tipare,
(b) prezenta propeptidelor de extensie si rata in care ele sunt indepartate enzimatic in timpul procesarii colagenului. Exista tipuri de colagen la care sunt prezente una sau ambele propeptide de extensie, care sunt regiuni globulare si influenteaza steric formarea fibrilelor,
(c) existenta glucidelor in moleculele de colagen. Studii experimentale au aratat ca glucidele influenteaza procesul de asamblare la mai multe nivele: in interiorul celulei, in timpul transportului si asamblarii timpurii si in compartimentele extracelulare in timpul depozitarii finale;
(d) portiunile telopeptidice ale moleculei de colagen ;
(e) asocierea moleculelor de colagen cu componenti extracelulari necolagenici
Modul in care acesti factori si procese intervin in controlul fibrilogenezei in vivo nu este pe deplin elucidat. In ceea ce priveste formarea fibrilelor de colagen in matricea extracelulara exista doua ipoteze:
1. Ipoteza cresterii prin nucleatie - care considera ca formarea fibrilelor de colagen este un proces mediat prin difuzie limitata cand colagenul monomeric se adauga la un multimer initial (un nucleu de cateva molecule care au un anumit aranjament termodinamic),
2. Ipoteza ansamblului intermediar - care considera ca moleculele de colagen formeaza agregate intermediare care se leaga apoi intre ele pentru a forma macromolecule, culminand in final antr-o fibrila.
Literatura privind asamblarea fibrilelor de colagen contine argumente atat pentru aditia monomerica prin crestere nucleata cat si pentru aditia intermediara prin asamblare in mai multi pasi. Parkinson si colab. au aratat ca asamblarea moleculelor de colagen in fibrile este un proces determinat de entropie, similar cu cel care are loc in alte sisteme de autoasamblare a proteinelor, cum ar fi microtubulii si filamentele de actina. Aceasta constatare demonstreaza ca forta majora responsabila pentru formarea fibrilelor este interactia hidrofobica intre moleculele de colagen.
Studii relativ recente asupra colagenilor fibrilari din vertebrate au evidentiat existenta unor segmente de fibrile cu o lungime de aproximativ 10 μm care sunt intermediari ai formarii fibrilelor mature, ce pot avea lungimi de sute de micrometri. Astfel de segmente fibrilare au fost identificate si in cornee ca precursori in asamblarea matricei sale stromale. S-a demonstrat ca existenta si cresterea acestor segmente intermediare au implicatii majore asupra morfogenezei, cresterii si refacerii tesuturilor. Intelegerea adecvata a asamblarii matricei poate fi insa atinsa numai in cazul in care produsul final al asamblarii este definit total din punct de vedere structural si chimic [4].
Comparativ cu tendonul si pielea la care s-a observat o crestere a diametrului segmentelor de fibrile proportionala cu cresterea lungimii acestora, in cornee, segmentele de fibrile cresc in lungime dar diametrele lor raman constante. Aceasta constatare evidentiaza ca in cornee predomina asocierea liniara a segmentelor care genereaza fibrile lungi dar cu diametru mic (aproximativ 20nm) si un aranjament ortogonal tipic.
Experimentele lui Birk si Trelstad au aratat rolul considerabil al fibroblastelor in formarea fibrilelor, benzilor si lamelelor de colagen prin controlul acestor celule asupra formei spatiului extracelular. Tehnicile de ME utilizate au evidentiat ca fibroblastul imparte spatiul extracelular in cel putin trei tipuri distincte de compartimente in interiorul carora formarea fibrilei de colagen, a benzilor si organizarea acestora in lamele se realizeaza intr-o maniera secventiala:
primul tip de compartiment este reprezentat de mici cavitati intim asociate cu suprafata celulara care contin in mod normal 5-12 fibrile de colagen. Formarea acestor cavitati se realizeaza prin fuziunea vacuolelor secretorii (care contin molecule de colagen), intre ele si cu suprafata celulara
al doilea compartiment se prezinta sub forma unui pliu de suprafata mai mare, in care fibrilele de colagen sunt grupate in benzi mici continand 50-100 fibrile. Aceste spatii au aparut ca rezultat al fuziunii laterale al catorva cavitati mici;
al treilea spatiu este cel mai mare compartiment de suprafata, in care benzile sunt asociate in lamele. Spatiile sunt formate prin fuziunea pliurilor de suprafata si dupa deteriorarea si retractia suprafetei celulare.
1.6. Degradarea colagenului
Biodegradarea colagenului in vivo este un proces complex ce se desfasoara in etape succesive specifice acestui tip de proteine si cu particularitati in functie de tipul de colagen din tesut. Exista dovezi asupra degradarii intracelulare si extracelulare a colagenului subliniindu-se ca procesul degradativ major este cel extracelular mediat de metaloproteinaze matriceale (MMP) si in special de colagenaze. Rolul degradarii intracelulare este sustinut de ipoteza ca acesta reprezinta un posibil mecanism de control al ratei de biosinteza a colagenului, de indepartarea sau remodelare a moleculelor modificate structural. De asemenea, este luata in considerare o posibila functie morfogenetica
Declansarea etapei de biodegradare este determinata de proteoliza spontana post translationala intracelulara, proces demonstrat in sisteme de cultura in vitro a mai multor tipuri celulare: fibroblaste, osteoblaste, condrocite si apreciat ca o dereglare metabolica incipienta pe care celula este capabila sa o blocheze prin proteoliza nespecifica. In cazul inducerii sintezei formei anormale de colagen (datorat in parte deficitului de vitamina C, a cresterii temperaturii, a AMP-c etc.) nivelul degradarii post translationale depaseste faza spontana si se ajunge la procolagen modificat. Rata degradarii colagenului care depaseate nivelul activitatii metabolice si se realizeaza cu participarea lizozomilor, poate fi inhibata de substante precum colchicina, care distrug reteaua transportoare intracelulara.
Experientele in vitro folosite pentru cultura membrelor de soarece in dezvoltare au dovedit proportii ridicate ale degradarii colagenului si au condus la aprecierea ca este posibila o functie morfogenetica a degradarii intracelulare a colagenului prin actiunea chemotactica a peptidelor mici de Hyp. Aceste date asociate altor observatii conduc la ipoteza ca degradarea intracelulara asigura un mecanism de control al cantitatii de colagen produs sau de inlaturare a moleculelor aberante, anormale structural. Incercari de masurare a acestui proces de degradare in vivo au fost efectuate pe piele si tesut pulmonar de iepuri infuzati cu prolina radioactiva.
Fractiunea de hidroxiprolina cu greutate moleculara scazuta a reprezentat 10-20%
din colagenul nou sintetizat, dar analiza cinetica a acestei fractiuni a aratat ca hidroxiprolina eliberata nu provenea din degradarea procolagenului intracelular, ci dintr-o alta sursa cu o productie mai lenta. Gradul si functia fiziologica a degradarii colagenului intracelular sunt deci inca neclare, dar acest factor trebuie luat in seama in incercarile de a modifica si diagnostica ratele degradarii colagenului. S-a remarcat ca in modificarea metabolismului colagenului poate fi implicata actiunea cuprului, considerat ca factor esential pentru activitatea liziloxidazei. In cazurile de deficienta de cupru la bovine, de exemplu, s-a demonstrat ca activitatea enzimei este mult mai scazuta.
Degradarea colagenilor nefibrilari
Actiunile de degradare a colagenului tip IV care constituie componenta majora a membranelor bazale este considerata foarte importanta, aceasta fiind necesara pentru intra- si extravazarea celulelor hemopoetice dar si tumorale, remodelarea capilarelor, cresterea si angiogeneza, epitelizarea in vindecarea ranilor. O actiune invadatoare manifesta si celulele canceroase. Colagenul tip IV sa dovedit a fi susceptibil la atacul unor proteinaze in vitro inclusiv plasmina si pepsina. Colagenazele tip IV produse de celulele tesutului conjunctiv si de PMN (monocite, macrofage) cliveaza specific colagenul tip IV la un situs din portiunea helicala a moleculei. O alta MMP a celulelor tesutului conjunctiv, stromelizina, poate actiona asupra regiunilor nehelicale asociate prin
legarea incrucisata a moleculelor, avand ca rezultat obtinerea de fragmente mari si solubile. Toate regiunile nehelicale sunt atacate de serin proteinaze, elastaza si catepsina G. Este posibil, de asemenea, ca si cistein proteinazele lizozomale sa actioneze similar la valori de pH mai acide.
Procesele de biosinteza si biodegradare ale colagenului se desfasoara in stransa interrelatie cu celelalte componente ale matricei extracelulare, in special cu proteoglicanii si alte glicoproteine. De asemenea, procesul de degradare reflecta o stransa interdependenta colagen- fibroblaste, macrofage, limfocite si alte celule, factori endocrini si sisteme imunitare. Testosteronul, hormonii tiroidieni si paratiroidieni stimuleaza activitatea colagenazelor si deci degradarea colagenului se intensifica. Opus acestora, o serie de factori de crestere si, de asemenea, insulina, somatomedina, care stimuleaza mitoza, conduc la stimularea fibrozarii stromei.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Lucrari pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








