
| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina Rolul nodulului santinela in stadializarea cancerului de san - partea speciala |
Rolul nodulului santinela in stadializarea cancerului de san - partea speciala
ROLUL NODULULUI SANTINELA IN STADIALIZAREA CANCERULUI DE SAN - PARTEA SPECIALA
1. Ipoteza si scopul lucrǎrii
"Cartografierea" limfaticǎ in cancerul de san este metoda standard de evaluare in vederea terapiei datoritǎ: acuratetii, scǎderii morbiditǎtii, scǎderii costurilor si a imbunǎtǎtirii confortului pacientilor comparativ cu vechile metode.
Orientand chirurgul cǎtre zona in care se aflǎ nodulul santinelǎ, se reduce timpul interventiei, dimensiunea inciziei si complicatiile legate de morbiditatea tardivǎ.
Scopurile acestei lucrǎri sunt:
testarea validitǎtii conceptului de nodul santinelǎ
crearea posibilitǎtilor pentru chirurg de a realiza biopsia nodulului santinelǎ intr-un mod cat mai exact si concret
popularizarea acestei metode pentru a o face usor de invatat, versatilǎ si aplicabilǎ in afara spitalelor universitare
2.Pregǎtirile preexaminatorii
Selectarea pacientilor:
Toti pacientii care necesitǎ o disectie axilarǎ in scopul stadializǎrii, aici fiind inclusi pacientii care necesitǎ o lobectomie cu disectie axilarǎ urmatǎ de radioterapie sau pacientii care necesitǎ o mastectomie standard sau radical modificatǎ.
Dacǎ este posibil diagnosticul de carcinom va trebui pus preoperator cu ajutorul FNA. Aceasta este consideratǎ o metodǎ cu mare acuratete in obtinerea diagnosticului histologic.
Desi majoritatea pacientilor care suferǎ de cancer de san ar putea fi considerati candidati, existǎ totusi si contraindicatii. Acestea pot fi impǎrtite in douǎ categorii: caracteristici ale tumorii si caracteristici ale pacientului.(9)
Pacientii cu tumori mari (mai mari de 5 cm in diametru) sau cu boalǎ avansatǎ local au sanse mai mari de a prezenta metastaze nodale, totusi in cazul lor vizualizarea drenǎrii limfatice nu ii va scuti intodeauna de o disectie axilarǎ totalǎ. In caz de metastazare limfaticǎ, celulele tumorale pot obstructiona vasele limfatice sau pot inlocui complet nodulul santinelǎ, rezultand o "hartǎ" limfaticǎ fǎrǎ acuratete.
Pacientii cu noduli axilari palpabili au o sansǎ mai mare de 90% de a avea metastaze axilare si de aceea nu sunt luati in considerare.
Pacientii cu carcinom ductal in situ (DCIS) si carcinom noninvaziv nu ar trebui "cartografiati" de rutinǎ. Existǎ totusi circumstante cand se poate efectua cartografierea, referindu-ne aici la posibilitatea existentei unui cancer invaziv care nu a fost diagnosticat corect sau a scǎpat diagnosticului
Aceastǎ "avansare" a carcinomului ductal in situ cǎtre carcinom invaziv are loc mai ales in cazul stadiilor avansate de carcinom ductal in situ si sunt diagnosticate cu ocazia unei biopsii diagnostice. In aceste cazuri chirurgul poate anticipa riscul unei tumori invazive si va cere efectuarea unei cartografieri limfatice cu ocazia rezectiei tumorii principale, pentru a explora si extinderea acesteia. In aceste cazuri este o indicatie subiectivǎ care depinde in mare mǎsurǎ de experienta si judecata chirurgului, radiologului si a anatomopatologului. Rolul nodulilor santinelǎ in carcinomul ductal in situ este discutabil si se aflǎ in atentia unor studii.
Caracteristicile pacientului care impiedeicǎ succesul vizualizǎrii limfatice sunt in general rezultatul fenomenelor care au alterat cǎile de drenare limfaticǎ a tumorii.
Acestea includ proceduri chirurghicale anterioare cum ar fi: implanturi mamare, mamoplastie de reductie sau interventii axilare. De asemenea chimioterapia preoperatorie si radioterapia pot afecta traseul canalelor limfatice, ajungandu-se astfel la rezultate fals pozitive.
Pacientii cu tumori multiple ale sanului, mai ales cei cu tumori situate in diferite cadrane, sunt de asemenea considerati candidati cu sanse mici, deoarece tumorile lor pot prezenta fiecare cǎi specifice de drenare care nu pot fi apreciate in timpul operatiei.
Pacientii cu leziuni mediale ale sanului si cei ale cǎror leziuni nu pot fi diagnosticate cu acuratete vor fi exclusi.
Pregǎtirea pacientului:
Nu este necesarǎ o pregǎtire specialǎ in vederea examinǎrii. Pacientul trebuie informat referitor la manoperele si examinǎrile ce i se vor face. Pacientul trebuie sǎ se dezbrace si sǎ isi dea jos toate bijuteriile situate deasupra taliei inaintea examinǎrii.
Inainte de injectare, medicul trebuie sǎ facǎ un examen complet al sanului, pentru a evalua anomaliile si un examen al nodulilor limfatici locoregionali. De asemenea, trebuie luate in calcul si alte explorǎri sau informatii care pot fi utile in interpretarea scintigrafiei cum ar fi:
faza ciclului menstrual (chiar dacǎ nu existǎ o influentǎ clar doveditǎ a acestuia asupra scintigrafiei)
mamografii recente in ultimile 4 sǎptǎmani
ecografii recente in ultimile 4 sǎptǎmani
alte examinǎri imagistice recente
In particular trebuie evaluate urmǎtoarele informatii, deoarece ele sunt cauze de rezultate fals pozitive: interventii chirurgicale asupra sanului sau proceduri de diagnostic invazive cum ar fi aspirarea cu ac a chistelor, lavajul ductal (in aceste cazuri scintigrafia va fi amanatǎ cel putin 2 sǎptǎmani), biopsii (scintigrafia se va amana 4-6 sǎptǎmani), interventii chirurgicale sau radioterapie (scintigrafia se va amana cel putin 2 luni), chemoterapie recentǎ.
3. Injectarea substantei de contrast, dozare si administrare:
Substanta de contrast se va administra prin injectare intravenoasǎ intr-o venǎ colateralǎ sanului care prezintǎ anomalia. Dacǎ boala este bilateralǎ injectarea se va face ideal in vena dorsalǎ a piciorului. O branulǎ poate fi montatǎ inaintea injectǎrii trasorului pentru a asigura un acces venos. Extravazarea perivenoasǎ poate duce la vizualizarea nodulilor limfatici normali din bazinul limfatic respectiv. Injectarea trasorului va fi urmatǎ de injectarea a 5-10 ml de solutie salinǎ
Activitatea radiofarmaceuticului ce urmeazǎ sǎ fie administrat trebuie sǎ fie determinatǎ, tinand cont de European Atomic Energy Community Treaty, si in particular de articolul 31 adoptat de Council of the European Union (Directive 97/43/EURATOM). Aceastǎ directivǎ imbunǎtǎteste directiva 96/29/EURATOM si garanteazǎ protectia individului impotriva pericolului reprezentat de radiatiile ionice in contextul expunerilor medicale cu scop diagnostic. Conform acestei directive, statele membre sunt obligate sǎ punǎ in practicǎ toate mǎsurile necesare pentru a respecta directiva. Unul dintre criterii este "Diagnostic Reference Levels" (DRL) referitor la radiofarmaceutice: acesta este definit ca nivele de activitate pentru grupuri de pacienti standard si echipamente standard. Trebuie luat, de asemenea, in considerare cǎ in fiecare tarǎ medicii si fizicienii de medicinǎ nuclearǎ trebuie sǎ respecte DRL-ul si regulile stabilite de legile tǎrii respective.
Activitatea Tc sestamibi sau tetrofosmin necesarǎ pentru o bunǎ calitate a imaginii trebuie sǎ fie cuprinsǎ intre 740 si 1.110 MBq (20-30 mCi). Injectarea unor trasori cu o activitate mai mare decat DRL-ul local trebuie justificatǎ. Organele care primesc cea mai mare dozǎ de radiatii sunt vezica urinarǎ si rinichiul.
Distributia fiziologicǎ a 99mTc-sestamibi si a 99mTc-tetrofosmin.
O concentrare a 99mTc-sestamibi poate fi observatǎ in vivo in mai multe organe, in particular poate fi observatǎ stocarea trasorului in glandele salivare, tiroidǎ, miocard, vezicǎ urinarǎ, intestin, rinichi, plexurile coroide si muschii scheletici. La cinci minute dupǎ injectare, aproape 8% din doza injectatǎ rǎmane incǎ in circulatie. Timpul de injumǎtǎtire este de aproximativ 3 ore pentru inimǎ si 30 minute pentru ficat.
In cazul folosiririi 99mTc-tetrofosmin, mai putin de 5% din doza injectatǎ rǎmane in sange la 10 minute de la injectare, fiind captatǎ predominant de muschi. Timpul de injumǎtǎtire este de aproximativ 4 ore pentru inimǎ si 30 minute pentru ficat.
Preluarea ambilor trasori in san si axilǎ este normalǎ. De asemenea, acumularea fiziologicǎ de trasor se poate observa la nivelul mamelonului.
Doza de radiatii, estimatǎ ca fiind absorbitǎ de san, in cazul folosirii 99mTc-sestamibi este de 0.0038 mGy/MBq, iar in cazul folosirii 99mTc-tetrofosmin doza este de 0.0005 mGy/MBq.
4. Metoda de lucru
Existǎ douǎ metode de vizualizare a nodulilor santinelǎ axilari:
metoda in care se injecteazǎ un colorant albastru (vital blue dye)
metoda scintigraficǎ in care se injecteazǎ 99mTc-sulfur coloid si 99mTc-tetrofosmin
Unii autori au combinat cele douǎ metode pentru a obtine o crestere a acuratetii identificǎrii nodulilor santinelǎ. Aceastǎ metodǎ, obtinutǎ prin combinarea celor douǎ tehnici, s-a dovedit a avea cea mai mare acuratete si senzitivitate. Voi aborda aceastǎ ultimǎ tehnicǎ rezultatǎ prin combinarea celor douǎ metode.
Aceastǎ tehnicǎ nouǎ castigǎ din ce in ce mai mult teren in cazul pacientilor care necesitǎ o disectie axilarǎ standard. Teoria din spatele acestei tehnici a fost introdusǎ de cativa autori care au postulat cǎ in cazul identificǎrii unui nodul santinelǎ axilar (primul nodul in calea drenǎrii limfatice) se poate face o corelatie intre acesta si statusul celorlalti noduli limfatici din axilǎ. Validitatea acestei teorii a fost afirmatǎ de Reintgen si colaboratorii, care au observat cǎ un nodul axilar poate fi identificat in 92% din cazuri la pacientii cu cancer de san, combinand metodele de vizualizare cu ajutorul colorantilor (blue dye) si al substantelor radioactive. De asemenea au observat cǎ un nodul santinelǎ va fi gǎsit pozitiv in cazul pacientilor cu invazie axilarǎ, pe cand un nodul santinelǎ negativ echivaleazǎ cu o axilǎ negativǎ din punct de vedere al invaziei tumorale.
Desi multi chirurgi incep sǎ foloseascǎ tot mai des aceastǎ tehnicǎ ca si metodǎ de stadializare, ea nu a intrat incǎ in practica standard. De obicei este executatǎ cu ajutorul unui departament experimentat de medicinǎ nuclearǎ.
5. Materiale:
Materialele folosite se impart in douǎ categorii:
substante injectabile (radiofarmaceutice)
aparatura de detectie (camera scintigraficǎ, sonda portabilǎ de detectie a radiatiilor gamma)
Substantele injectabile se impart la randul lor in douǎ tipuri:
colorantii (Isosulfan Blue, Vital Blue Dye
substantele radioactive, trasori coloidali (99mTc-sestamibi, 99mTc-tetrofosmin)
Radiofarmaceuticele:
a) LYMPHAZURIN ® 1% (Isosulfan Blue - Vital Blue Dye)
Ca si formǎ de prezentare poate fi gǎsit in pachete complexe pentru vizualizarea limfaticǎ sau poate fi ambalat sub forma unui flacon. Doza uzualǎ este de 3 ml pentru locatia tumorii. Acest colorant albastru (solutie apoasǎ sterilǎ) este clasificat ca si substantǎ inertǎ fiziologic si nu are actiuni farmacologice cunoscute.
b) 99mTc-sestamibi
Este comercializat sub denumirea de Cardiolite, se gǎseste sub formǎ liofilizatǎ ca sare de Cu(I) a 2-methoxi isobutilisonitril (2-methoxy isobutylisonitrile) ambalat in flacoane.
Prepararea trasorului
 99mTc-sestamibi este preparat prin adǎugarea unei
cantitǎti de sodiu 99mTc-pertechnetate diluat in solutie
salinǎ sterilǎ si incǎlzirea la 100 de grade Celsius timp
de 10 minute conform indicatiilor producǎtorului
99mTc-sestamibi este preparat prin adǎugarea unei
cantitǎti de sodiu 99mTc-pertechnetate diluat in solutie
salinǎ sterilǎ si incǎlzirea la 100 de grade Celsius timp
de 10 minute conform indicatiilor producǎtorului
Controlul calitǎtii
Concentratia radioactivǎ va fi determinatǎ mǎsurand activitatea intr-o camerǎ de ionizatie calibratǎ. Puritatea radiochimicǎ poate fi confirmatǎ utilizand o metodǎ TLC. Eficienta rezultatǎ trebuie sǎ fie mai mare de 90%.
Precautii speciale.
Preparatul se poate dilua cu solutie salinǎ sterilǎ dacǎ e necesar. De asemenea, preparatul trebuie folosit in aproximativ 6 ore de la preparare. S-a observat cǎ radiofarmaceuticul are o usoarǎ tendintǎ de a fi absorbit in unele flacoane si seringi. (19)
c) 99mTc-tetrofosmin
Este comercializat sub denumirea de Myoview. Se gǎseste sub formǎ liofilizatǎ 0,23 g de tetrofosmin, sulfosalicilat disodic, D gluconat de sodiu si alti excipienti ambalati in flacoane.
Prepararea trasorului
99mTc-tetrofosmin este preparat prin adǎugarea unei cantitǎti de sodiu 99mTc-pertechnetate diluat in solutie salinǎ sterilǎ in flacon conform indicatiilor producǎtorului.
Controlul calitǎtii
Concentratia radioactivǎ va fi determinatǎ mǎsurand activitatea flaconului intr-o camerǎ de ionizatie calibratǎ. Puritatea radiochimicǎ poate fi confirmatǎ utilizand o metodǎ ITLC/SG. Eficienta rezultatǎ trebuie sǎ fie mai mare de 90%. (23)
Dupǎ injectare radiofarmaceuticele circulǎ prin vasele limfatice, de aceea ele vor fi filtrate inainte de injectare prin site speciale, pentru a obtine o particulǎ radiocoloidalǎ suficient de micǎ pentru a evita fagocitele.
Comportamentul coloizilor injectati interstitial depinde foarte mult de dimensiunea particulei. Dimensiunea radiocoloizilor care au fost utilizati pentru limfoscintigrafie variazǎ de la cativa nanometrii panǎ la sute de nanometri. Aceia care par a avea o importantǎ clinicǎ au mai putin de 100 nm in diametru. Dimensiunea optimǎ a coloidului pentru limfoscintigrafie este de 10-50 nm. Particulele mai mici pot fi preluate de vasele capilare de sange si distribuite preferential ficatului si splinei in timp ce particulele mai mari raman in raza de actiune a injectiei. Captarea particulelor in sistemul limfatic dupǎ 5 ore este de aproximativ 50-80% pentru particulele intre 10-20 nm, 20% pentru particulele de 40 nm si mai putin de 10% pentru particulele mai mari de 100 nm. Dimensiunea particulei de 99mTc, cel mai folosit dintre agentii coloidali, variazǎ intre 15-40 nm.
Existǎ, de asemenea, o legǎturǎ intre numǎrul de particule coloidale injectate, raza de absorbtie a substantei, raza de actiune a substantei dupǎ injectare, cat si gradul de absorbtie intranodal. Pentru 99mTc numǎrul de particule in suspensiile injectabile variazǎ intre 1O10 panǎ la 1O13/ml solutie. In cateva ore, panǎ la 30% din doza injectatǎ este absorbitǎ de la locul injectǎrii. Prin urmare, timpul optim pentru a realiza o imagine externǎ a nodulilor limfatici este de trei ore de la injectare. (43)
Tehnicile mai noi presupun filtrarea coloizilor prin site de 0,2 microni pentru a obtine particule radiocoloidale suficient de mici pentru a evita fagocitele si a inlǎtura neajunsurile legate de dimensiunile prea mari care impiedicǎ rǎspandirea particulelor in curentul limfatic.
Aparatura de detectie
Aparatura ce stǎ la baza detectiei radiatiei gamma, a formǎrii si prelucrǎrii imaginii scintigrafice este reprezentatǎ de camera de scintilatie si calculatorul electronic.
Camera de scintilatie este alcǎtuitǎ din colimator, detectorul de scintilatie, tuburile fotomultiplicatoare, circuitele de preamplificare si amplificare, analizatorul de impulsuri si osciloscopul.
Principiul care stǎ la baza functionǎrii camerei de scintilatie constǎ in detectarea radiatiei gamma emise in urma injectǎrii unui radiofarmaceutic cu tropism pentru un anumit organ, in acest caz sanul, si convertirea fotonilor emisi in semnale electrice care ulterior, in urma unor prelucrǎri succesive, redau pe ecranul osciloscopului, sub formǎ de imagine scintigraficǎ, distributia spatialǎ a radiotrasorului, oferind informatii despre morfologia si functia organului investigat.
Colimatorul este o placǎ de plumb perforatǎ, prevǎzutǎ cu canale si pereti despǎrtitori (septuri), care se interpune intre pacient si cristalul de scintilatie. Rolul acestuia este de a nu permite trecerea spre cristal decat a radiatiei ce provine dintr-un teritoriu bine delimitat, in vederea realizǎrii imaginii scintigrafice a organului explorat. Rezolutia spatialǎ si sensibilitatea sunt influentate de lungimea septurilor (dacǎ creste lungimea septurilor, creste rezolutia, dar scade sensibilitatea).
Colimatorul multiplanar paralel are axele canalelor perpendiculare pe suprafata cristalului de scintilatie, iar grosimea septurilor variazǎ in functie de energia radiofarmaceuticului utilizat. Lungimea septurilor influenteazǎ sensibilitatea si rezolutia colimatorului, deoarece cantitatea de radiatii care ajung la detector este invers proportionalǎ cu pǎtratul lungimii canalului. Rezolutia este cu atat mai bunǎ cu cat organul de explorat este mai aproape de colimator, vizualizarea scintigraficǎ cu acest tip de colimator necesitand plasarea colimatorului cat mai aproape de aria de proiectie la suprafatǎ a organului respectiv. Astfel, imaginea organului explorat va fi constituitǎ din multimea de proiectii ale ariilor "vǎzute" de cristal prin aceste orificii.
Colimatorul trebuie sǎ fie unul cu energie scazutǎ si rezolutie mare, fereastra energeticǎ pentru achizitia imaginilor trebuie sǎ fie centratǎ pe 140 keV, varful de emisie al 99mTc.
Cristalul de scintilatie este format din iodurǎ de sodiu, activatǎ cu thaliu, care are proprietatea de fluorescentǎ cand absoarbe radiatii gamma.
La trecerea printr-o substantǎ, radiatia gamma este atenuatǎ, intensitatea sa scǎzand dupǎ o lege exponentialǎ de forma: I=I'e-mx in care:
- I - este intensitatea fasciculului dupǎ parcugerea unei distante X in mediul
considerat
- I' - este intensitatea fasciculului incident
- m- este coeficientul de atenuare, care depinde de:
radiatia gamma
numǎrul atomic al elementelor din care aceasta este constituitǎ
energia fotonilor incidenti
Radiatia gamma, dupǎ trecerea prin canalele colimatorului, ajunge la suprafata cristalului de scintilatie cu care interactioneazǎ prin efect fotoelectric (efect predominant in cazul radiatiilor cu energie joasǎ, cum este 99mTc, cu care se efectueazǎ majoritatea explorǎrilor scintigrafice). Prin efect fotoelectric, radiatia gamma isi cedeazǎ intreaga energie unui electron legat de structura atomului cristalului, pe care il smulge de pe orbitǎ, producand o scintilatie a cǎrei intensitate este proportionalǎ cu energia absorbitǎ. Datoritǎ transparentei cristalului, fotoelecronul va ajunge la fotomultiplicatorul cel mai apropiat. In cazul efectului fotoelectric, scintilatia corespunde spatial punctului de unde a fost emisǎ radiatia.
Prin efect Compton, caracteristic radiatiilor cu energii medii, radiatia gamma isi cedeazǎ o parte din energie unui electron liber sau usor legat, continuandu-si parcursul cu o energie micsoratǎ; in functie de energia rǎmasǎ, radiatia va interactiona in continuare, fie cedandu-si succesiv energia unor electroni liberi (fenomen de imprǎstiere), fie cedand-o in final, total prin efect fotoelectric unui electron legat. La efectul Compton, datoritǎ imprǎstierii, scintilatia va apǎrea departe de punctul din care s-a emis radiatia primarǎ.
Tuburile fotomultiplicatoare au rolul de a converti impulsul luminos eliberat de cristal intr-un semnal electric a cǎrui mǎrime se poate mǎsura; mǎrimea semnalului electric este direct proportionalǎ cu energia totalǎ a fotonilor gamma absorbiti de cristal. Eficienta captǎrii scintilatiilor emise de cristal in scopul formǎrii imaginilor, depinde de numǎrul fotomultiplicatoarelor, de geometria si modul lor de pozitionare pe suprafata cristalului.
Un tub fotomultiplicator cuprinde:
un catod, care elibereazǎ fotoelectronul in urma lovirii sale de cǎtre fotonii emisi de cristal
un numǎr determinat de diode fotomultiplicatoare, care multiplicǎ electronii, accelerati progresiv de o sursǎ de tensiune, ce lovesc succesiv diodele, ajungand in final la 1 - 10 milioane de electroni pentru fiecare electron eliberat la suprafata fotocatodului;
anodul care colecteazǎ fluxul de electroni si il transmite unui rezistor pentru a forma un puls de tensiune, ce constituie semnalul de iesire al tubului fotomultiplicator.
Materialul siliconic transparent prin care tuburile fotomultiplicatoare sunt conectate optic la cristalul de scintilatie permite captarea maximǎ a evenimentelor luminoase produse in cristal.
Localizarea scintilatiei in imaginea finalǎ depinde de cantitatea de luminǎ sesizatǎ de fiecare tub fotomultiplicator. Semnalul global corespunzǎtor unei scintilatii se obtine prin insumarea semnalelor de iesire ale tuburilor fotomultiplicatoare care au captat acest fenomen. El are douǎ componente care dau relatii asupra localizǎrii spatiale pe axele x si y (semnalele x si y ) si o componentǎ z, care furnizeazǎ informatii asupra intensitǎtii. Semnalele x si y sunt transmise, fie la ecranul osciloscopului, fie la calculator pentru inregistrare. Semnalul z se prelucreazǎ in analizatorul de impulsuri.
Circuitele de amplificare si preamplificare, amplificǎ in intensitate si tensiune, semnalele de iesire ale tuburilor fotomultiplicatoare care au o amplitudine prea micǎ pentru a putea fi transmise si inregistrate.
Circuitele de formare intrerup brusc sfarsitul fiecǎrui impuls pentru a evita aglomerarea si suprapunerea lor, astfel incat semnalul care se transmite mai departe sǎ fie proportional cu energia fotonului incident care 1-a generat.
Analizatorul de impulsuri (spectrometrul) are rolul de a elimina semnalele provocate de radiatia de fond, cea dispersatǎ sau radiatiile altor izotopi cu care se interfereazǎ radiatia de bazǎ; dispozitivul selecteazǎ astfel numai semnalele corespunzǎtoare fotonilor proveniti din regiunea examinatǎ, care si-au eliberat complet energia in cristal; el alege numai acele portiuni din spectrul de emisie ce caracterizeazǎ energiile cuprinse intre anumite valori si le eliminǎ pe cele mai mari sau mai mici, care nu provin din zona de interes "vǎzutǎ" de colimator si care ar furniza informatii false in alcǎtuirea imaginii finale. Rezultǎ astfel o fereastrǎ a spectometrului cu o limitǎ inferioarǎ si alta superioarǎ (lǎtimea ferestrei). Orice semnale situate in afara ferestrei nu vor fi luate in considerare.
Osciloscopul cu persistentǎ permite controlul imaginii distributiei radiotrasorului in organul vizualizat si proportionarea corectǎ, iar al doilea fǎrǎ persistentǎ, este utilizat pentru obiectivarea imaginii scintigrafice. Calculatorul este un sistem complex care achizitioneazǎ, stocheazǎ, prelucreazǎ si afiseazǎ informatii. Prelucrarea datelor se face rapid, dupǎ reguli bine stabilite, constituite in programe de instructiuni.
Achizitionarea datelor se poate face in douǎ moduri: in functie de timp si in functie de numǎrul de impulsuri.
|
In memorie, datele se stocheazǎ sub formǎ de imagine sau histogramǎ. Sub formǎ de imagine, datele sunt plasate astfel incat sǎ formeze o matrice de cifre, care reprezintǎ distributia radiotrasorului. Dupǎ convertirea datelor in diferite nivele de intensitate, datele inscrise in matrice sunt transferate celulǎ cu celulǎ pe ecranul monitor, alcǎtuind in final imaginea. Cu cat numǎrul de celule din care este formatǎ matricea de imagine este mai mare, cu atat rezolutia imaginii este mai bunǎ.
Sub formǎ de histogramǎ, semnalele se depun in memorie secvential, dupǎ lista evenimentelor care se succed in timp. Acest mod are dezavantajul unei rate mici de achizitie si necesitǎ un volum mai mare de memorie decat in cazul in care stocarea s-a fǎcut sub formǎ de imagine.
O altǎ posibilitate pe care o oferǎ calculatorul este aceea de marcare a uneia sau mai multor zone de interes de pe imagine, direct pe ecranul monitorului, cu ajutorul unui creion luminos. In urma acestei operatii, impulsurile corespunzǎtoare acestor arii pot fi calculate si comparate. Aceastǎ facilitate este deosebit de utilǎ mai ales in cazul studiilor dinamice, cand apar modificǎri ale radioactivitǎtii in timp.
Alte programe de corectie a imaginilor constau in extragerea activitǎtii fondului intr-un anumit procent, in efectuarea unor operatii de indepǎrtare a neuniformitǎtilor sau de mǎrire a unei portiuni din imagine in scopul efectuǎrii unei analize mai amǎnuntite.
Controlul calitǎtii camerei de scintilatie:
Un program strict de control al calitǎtii si care sǎ respecte directiva 97/43/ a Council Directives EURATOM, precum si legile tǎrii respective trebuie efectuat de rutinǎ.
Sonda portabilǎ de detectie a radiatiilor gamma este practic un contor Geiger Muller.

Fig.23 NEOPROBE 1000T
Tehnica vizualizǎrii nodulului limfatic santinelǎ
Pasul 1: Injectarea substantelor
Aceastǎ tehnicǎ foloseste o injectie combinatǎ care contine, 3 ml 1% Vital Blue Dye (Isosulfan Blue) si 5 cc 99 Technetium, care se va injecta circumferential in jurul tumorii sau cavitǎtii seroase in cantitǎti egale. Se are in vedere sǎ nu se injecteze direct in tumorǎ sau cavitate deoarece se va diminua preluarea limfaticǎ.
Pentru leziunile nonpalpabile, radiofarmaceuticul nu este administrat prin acul de ghidaj, ci circumferential inconjurand varful acului, la adancimea doritǎ. Ultrasonografia este folositǎ frecvent pentru ghidare. S-a stabilit cǎ 3-5 minute de masaj usor la locul injectǎrii imbunǎtǎtesc preluarea limfaticǎ a substantei de contrast in nodulii limfatici.
Substanta radiocativǎ este injectatǎ in jurul tumorii cu 2 panǎ la 4 ore inaintea interventiei, folosind acul de ghidaj sau prin injectare directǎ. O cantitate de aproximativ 400-450 de μCi ar trebui injectatǎ la periferia tumorii.
Colorantul (vital blue) este injectat tot in periferia tumorii cu aproximativ 15 minute inaintea interventiei chirurghicale, folosind acul de ghidaj.
Existǎ mai multe tehnici de injectare corespunzǎtoare diferitelor regiuni anatomice unde se injecteazǎ substanta de contrast: intraparenchimal, dermal sau subdermal, si in plexul subareolar.
Tehnica dermalǎ se pare ca are o acuratete mai mare decat cea intraparenchimatoasǎ peritumoralǎ, vizualizand de asemenea si un numǎr mai mare de noduli.
Tehnica subareolarǎ este mai recentǎ si oferǎ aceleasi avantaje ca si cea dermalǎ:
e usor de executat,evitǎ necesitatea injectǎrii sub control imagistic, si mǎreste distanta de la tumorǎ la nodulul santinelǎ evitand artefactele provenite de la leziunile din cadranul supero-extern.(35)
In ciuda acestor avantaje unele institutii continua sa utilizeze injectarea intraparenchimala, deoarece este singura tehnica capabila sa identifice nodulii limfatici mamari interni.
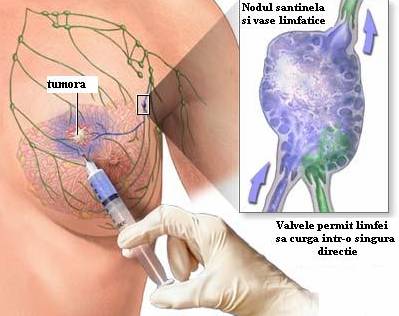
Fig.24 Injectarea colorantului (blue dye)
Mai nou, unii chirurgi folosesc aceastǎ tehnicǎ la pacientii care au suferit o lobectomie. In aceste cazuri, injectia se va face la periferia locului biopsiei sau a lobectomiei. Chirurgul va trebui sǎ fie atent sǎ nu injecteze centrul cavitǎtii, deoarece in multe cazuri, acesta va rǎmane chistic (serom), timp de cateva sǎptǎmani.
Pasul 2: Vizualizarea si identificarea nodulilor santinelǎ
1. Localizarea celei mai mari concentratii de substantǎ radioactivǎ
Pacientul este asezat in decubit dorsal, dedesubtul camerei care preia radiatiile gamma. O camerǎ de scintilatie si un colimator de inaltǎ rezolutie sunt folosite pentru captarea imaginii. Bratul este ridicat deasupra capului si palma este plasatǎ sub cap, pentru a optimiza expunerea axilarǎ. Sanul poate fi ecranat cu plumb sau poate fi indepǎrtat din aria de interes. Osciloscopul de persistentǎ este folosit pentru a identifica acumulǎri de radiofarmaceutic, corespunzǎtoare nodulilor limfatici.
Nodulii limfatici mamari interni si cei supraclaviculari pot fi marcati in proiectia anterioarǎ, pe cand cei axilari sunt marcati cu pacientul in decubit lateral cu bratul deasupra capului. Imaginile sunt obtinute in pozitiile anterioarǎ, lateralǎ si oblicǎ. Pacientul poate fi vizualizat cu ajutorul unei surse pe bazǎ de cobalt pentru a defini conturul corpului. Alternativ conturul corpului si punctele de reper pot fi vizualizate si cu Tc-99m. Preluarea imaginilor se va face imediat dupǎ injectare si dupǎ 2-4 ore de la injectare.
La momentul interventiei chirurghicale, se va scana in primul rand axila si regiunile marcate cu substantǎ de contrast pentru a detecta zonele cu activitate. Locul tumorii primare este injectat cu colorant (blue dye), 5-10 cc, cu o tehnicǎ asemǎnǎtoare celei de injectare a radiofarmaceuticului.
O sondǎ detectoare de radiatii gamma portabilǎ este folositǎ pentru a identifica, inainte de a face incizia, locul injectǎrii substantei coloidale (cea mai mare valoare, mai mult de 15000u) si zona cu cea mai intensǎ activitate radioactivǎ din axilǎ.
 Fig.25 Aparatura
portabilǎ de detectie a radiatiilor gamma
Fig.25 Aparatura
portabilǎ de detectie a radiatiilor gamma
2.Incizia tegumentului se va face in zona cu maximǎ activitate. Intrarea in axilǎ se va face cu mare atentie, se vor identifica canalele limfatice aferente, care au captat colorantul (blue dye) si se vor urmǎri panǎ la nodulii santinelǎ.
Nodulii limfatici suspecti sunt apoi incizati si se va avansa aferent cu disectia de-a lungul limfaticelor marcate cu substanta colorantǎ panǎ la nodulii limfatici santinelǎ. O atentie suplimentarǎ este acordatǎ evitǎrii scurgerii de sange si lichid limfatic. O sondǎ gamma portabilǎ creste acuratetea acestei examinǎri.
Dupǎ excizia initialǎ se va scana din nou axila cu sonda gamma. Disectia va fi continuatǎ dacǎ nivelul radiatiilor din axilǎ este de 150% fatǎ de normal.
Nodulii santinelǎ sunt definiti ca oricare nodul colorat sau oricare nodul cu un nivel al radiatiilor in vivo egal sau de trei ori mai mare decat normalul.
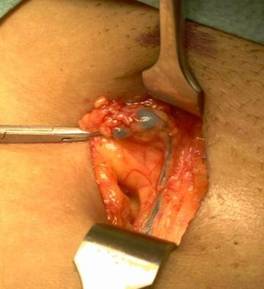
Fig.26 Localizarea intraoperatorie a nodulului
santinelǎ
3.Confirmarea localizǎrii nodulilor santinelǎ.
Nodulii limfatici colorati cu albastru sunt excizati. Se vor controla pentru urme de substantǎ radioactivǎ. Acelasi control se va face si asupra nodulilor non-santinelǎ din axilǎ. In al doilea rand, se vor aprecia nodulii santinelǎ potentiali in raport cu cei nonsantinelǎ. O valoare peste 10 indicǎ existenta unui nodul santinelǎ. In al treilea rand, se va verifica locul rezectiei. Dacǎ activitatea radioactivǎ va fi cel putin de 1,5 ori mai mare decat nivelul de fond, confirmǎ existenta si a altor noduli santinelǎ care trebuie cǎutati.
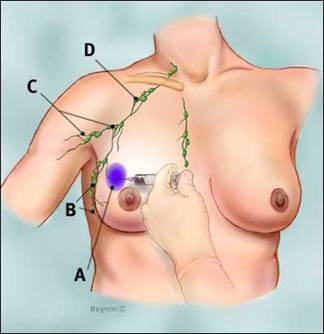 Fig.27 Injectarea colorantului(blue dye)
Fig.27 Injectarea colorantului(blue dye)
A. locul injectǎrii colorantului (blue dye)
B. nodulii limfatici axilari: statia I
C.nodulii limfatici axilari: statia II
D.nodulii limfatici axilari: statia III
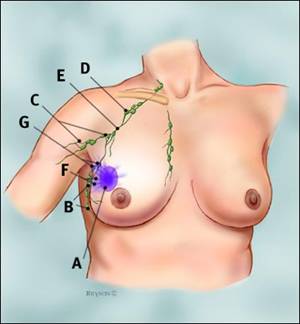
Fig.28 Drenarea colorantului (blue dye) de la locul injectǎrii, prin canalele limfatice, spre axilǎ.
A.locul injectǎrii colorantului (blue dye)
B.nodulii limfatici axilari: statia I
C.nodulii limfatici axilari: statia II
D.nodulii limfatici axilari: statia III
E.canale limfatice largi
F.canale limfatice inguste
G.noduli santinelǎ care au captat colorantul
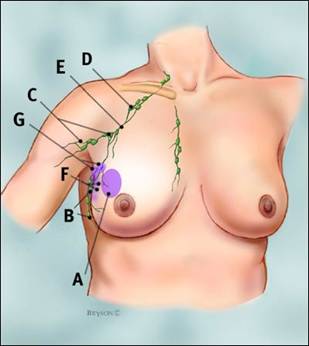
Fig.29 Drenarea colorantului (blue dye) de la locul injectǎrii, prin canalele limfatice, spre axilǎ.
A. locul injectǎrii colorantului (blue dye)
B. nodulii limfatici axilari: statia I
C.nodulii limfatici axilari: statia II
D.nodulii limfatici axilari: statia III
E.canale limfatice largi
F.canale limfatice inguste
G.noduli santinelǎ care au captat colorantul
(69)
4. Etichetarea nodulilor santinelǎ.
Nodulii santinelǎ rezecati sunt etichetati si trimisi anatomopatologului pentru examen histologic. Un avantaj al biopsiei nodulului santinelǎ, insuficient explorat, este oportunitatea oferitǎ anatomopatologului de a realiza o analizǎ mai amǎnuntitǎ a materialului bioptic. Pe masurǎ ce tehnologia a evoluat, a evoluat de asemenea si capacitatea de detectie a celulelor tumorale care afecteazǎ nodulii limfatici, care erau panǎ de curand nedetectabile. Hematoxilin eozina este capabilǎ sǎ detecteze o celulǎ tumoralǎ aflatǎ intr-o masǎ de 10.000 de celule normale, imunohistochimia poate detecta o celulǎ tumoralǎ dintre 100.000 de celule normale, iar reactia de revers transcriptaz polimerazǎ poate decela o celulǎ tumoralǎ aflatǎ intre 1.000.000 de limfocite normale
Pasul 3. In cazurile in care intraoperator se descoperǎ o gravitate mult mai mare a leziunii decat cea presupusǎ initial se va trece la o interventie clasicǎ cu lobectomie sau mastectomie
Probleme tehnice
Fenomenul de strǎlucire, raportat de Albertini si colab.(2) se produce cand tumora se aflǎ prea aproape de axilǎ, interferand astfel cu datele primite din axilǎ referitoare la substanta radioactivǎ. In aceste cazuri lobectomia sau mastectomia trebuie efectuate pentru a elimina aceasta interferentǎ.
Tumorile localizate in cadranul intern nu se preteazǎ la aceastǎ tehnicǎ din cauza localizǎrii. Drenajul limfatic al acestor tumori se face prin nodulii mamari interni.
Tendinta observatǎ in progresia tumorilor de a sǎri peste unele statii limfatice. Existǎ numeroase temeri legate de metastazele la distantǎ. Aceastǎ scurtcircuitare a unor statii limfatice are loc in aproximativ 15% din cazuri dupǎ unii autori. Totusi, Albertini si colab. au demonstrat cǎ aceasta nu afecteazǎ vizualizarea nodulilor santinelǎ.
Chiste/seroame la locul biopsiei sau al lobectomiei. Pacientii care au avut o biopsie sau o lobectomie in antecedente vor avea un serom postoperator la locul interventiei. Chirurgul trebuie sǎ fie extrem de atent sǎ nu injecteze colorantul sau substanta radioactivǎ in acest serom, deoarece acesta va capta colorantul sau substanta radioactivǎ si va invalida rezultatele. In schimb, marginile lobectomiei trebuie injectate pentru a controla existenta unor resturi ale tumorii.
Surse de eroare(9):
leziuni de dimensiune micǎ (< 1 cm)
extravazarea substantei de contrast, rezultand arii de captare anormalǎ a substantei de contrast in regiunea axilarǎ
miscarea sau pozitionarea gresitǎ a pacientului si asezarea detectorului cat mai aproape posibil de pacient
alte leziuni patologice ce pot fi confundate sau pot masca un cancer
tratamentul citostatic care poate reduce capacitatea de absorbtie a trasorului in tumorǎ
aplicarea tehnicii post-chirurgical sau post-radioterapie
Prezentare cazuri clinice
Limfoscintigrafie
Se vor injecta 0.2-0.5 ml de albumine serice (100-200nm) marcate cu 99Tc subdermal sau in jurul tumorii, dupǎ care se va masa usor zona pentru a favoriza rǎspandirea substantei in tesuturi.
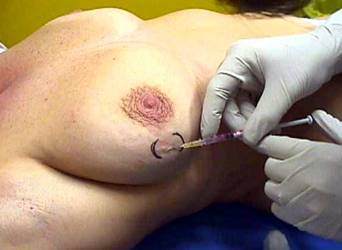
Preoperator se efectueazǎ o limfoscintigrafie la 15-30 de minute dupǎ injectare, pentru a determina ariile de acumulare focalǎ a radiotrasorului.
Se capteazǎ 2 imagini una in incidentǎ oblic anterioarǎ, deoarece se considerǎ cǎ aceasta este pozitia optimǎ pentru a se vizualiza proiectia axilei si una in incidentǎ ǎnterioarǎ pentru a exclude alte localizǎri ale nodulului santinelǎ
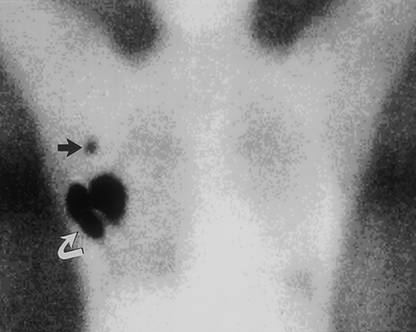
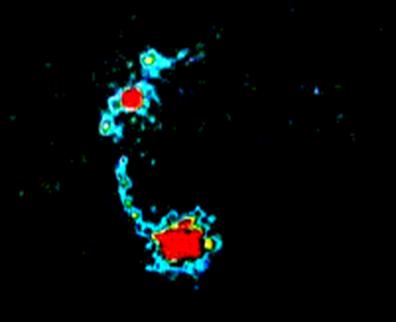
Se observǎ acumularea substantei la locul injectǎrii si drenajul cǎtre nodulul santinelǎ din axilǎ. Se vor marca pe piele ariile de proiectie.
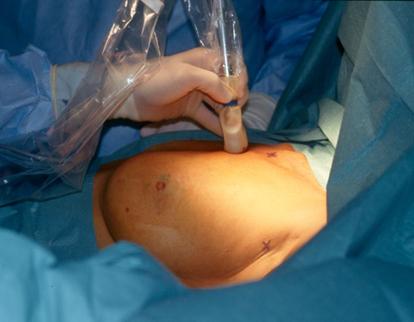
Intraoperator chirurgul se foloseste de o sondǎ portabilǎ de detectie a radiatiilor gamma emise de radiotrasor, astfel fiind capabil sǎ determine localizarea optimǎ unde va face incizia.
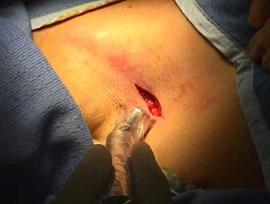
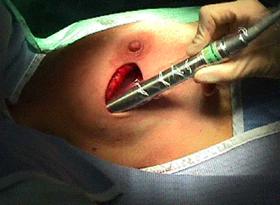
Localizarea exactǎ a leziunii poate fi verificatǎ cu ajutorul sondei gamma in orice moment pe parcursul interventiei in vederea izolǎrii ei..
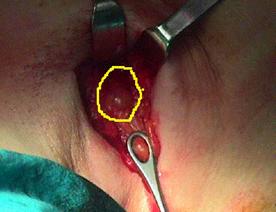
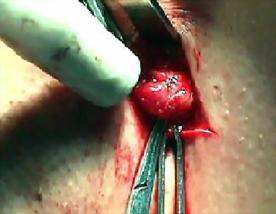
Odatǎ localizat, nodulul santinelǎ va fi excizat, i se va verifica radioactivitatea si va fi trimis spre analizǎ anatomopatologului, care va efectua sectiuni inghetate.


Tehnica Blue Dye
In sala de operatie se vor injecta 1-2 ml de substantǎ colorantǎ (patent blue, blue dye) subdermal sau peritumoral, dupǎ care se va masa usor zona pentru a favoriza rǎspandirea substantei in tesuturi.
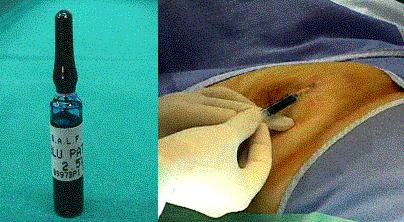
Intraoperator chirurgul urmari traiectul vaselor limfatice colorate, panǎ la primul nodul limfatic colorat (nodul santinelǎ) .
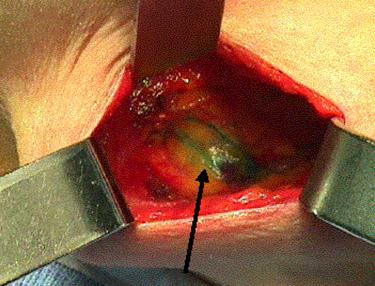
Nodulul gǎsit va fi excizat si se va continua cǎutarea celorlalti noduli care au captat colorantul.
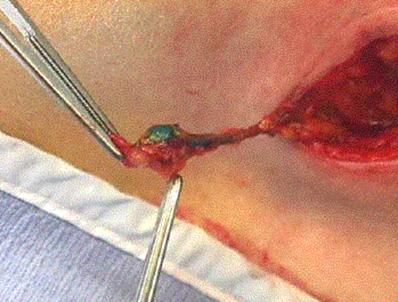
Nodulii limfatici excizati sunt trimsi spre analizǎ anatomopatologului

Localizarea nodulilor santinelǎ poate fi obtinutǎ in 65% din cazuri folosind doar metoda cu injectare de colorant (blue dye) si in 71-97,5% dacǎ se foloseste doar metoda cu substantǎ radioactivǎ. In cazul combinǎrii celor douǎ metode, s-a observat o rata a localizǎrii de 92%.
Discutii
Nodulul santinelǎ este definit ca fiind primul nod al bazinului limfatic in care tumora primarǎ se va drena. Limfaticele aferente primare se dreneazǎ in nodulul santinelǎ al respectivului bazin, de aceea statusul nodulului santinelǎ va reflecta statusul intregului bazin. Dacǎ nodulul santinelǎ nu este afectat de metastaze, statiile limfatice urmǎtoare ar trebui, de asemenea, sǎ fie negative. Tot astfel, dacǎ nodulul santinelǎ prezintǎ afectare metastaticǎ, existǎ riscul ca si statiile limfatice urmǎtoare sǎ contina celule canceroase.
Majoritatea autorilor sunt de acord acum cǎ in cazul gǎsirii unui nodul santinelǎ negativ nu mai este necesarǎ disectia axilarǎ, dar, pe de altǎ parte, nu existǎ un consens cu privire la conduita care trebuie urmatǎ in cazul pacientilor cu noduli santinelǎ pozitivi (trebuie sau nu trebuie sǎ fie supusi unei disectii axilare complete presupunand cǎ stadializarea axilarǎ a fost facutǎ).
Acest concept a fost descris pentru prima datǎ in carcinomul de penis in 1977 si a fost studiat apoi la pacientii cu melanom cutanat. (47)
Dacǎ biopsia nodulilor santinelǎ nu este efectuatǎ la momentul primei interventii chirurghicale, un numǎr semnificativ pacienti (>10%) este posibil sǎ prezinte un cancer invaziv, care va necesita o nouǎ interventie chirurgicalǎ si, cel mai probabil si o disectie axilarǎ completǎ. Majoritatea acestor pacienti vor avea un status bioptic negativ al axilei, dar din pǎcate nu vor mai putea profita de avantajele biopsiei nodulilor santinelǎ, din cauza neefectuǎrii la momentul initial a acestei manopere.
Rolul cartografierii limfatice in cazul mastectomiei profilactice se bazeazǎ pe aceleasi considerente.
Cartografierea limfaticǎ este mai greu de fǎcut dupǎ o lobectomie si este imposibil de efectuat dupǎ o mastectomie.
Dacǎ un cancer de san este descoperit accidental si biopsia nodulului santinelǎ este negativǎ, disectia axilarǎ completǎ poate fi evitatǎ. De asemenea, biopsia nodulului santinelǎ este o metodǎ eficace in descoperirea cancerelor oculte.
Dimensiunea tumorii primare si tipul histologic al metastazelor din nodulul santinelǎ sunt factorii principali care determinǎ afectarea sau nu si a nodulilor limfatici nonsantinelǎ. Totusi, riscul existentei metastazelor in nodulii limfatici nonsantinelǎ este semnificativ. (34)
Implicatiile prognostice ale nodulului santinelǎ fals negativ sunt nesigure, dar ar trebui comparate cu ratele mari ale morbiditǎtii in cazul disectiei axilare la femeile cu noduli negativi.
Existǎ cu sigurantǎ o marjǎ de eroare in evaluarea anatomo-patologicǎ a specimenelor prelevate prin disectie axilarǎ, care pot subestima metastazele cu 11-30% (38), pe cand prelevarea de mostre aleatorii din axilǎ nu reuseste sǎ indepǎrteze nodulii implicati. Rata rezultatelor fals negative trebuie in cele din urmǎ sa fie minimizatǎ prin detectia cat mai exactǎ a nodulilor santinelǎ prin scintigrafie, o tehnicǎ intraoperatorie cat mai meticuloasǎ, o evaluare anatomo-patologicǎ optimǎ, toate acestea necesitand o echipǎ multidisciplinarǎ cu experientǎ.
Limfoscintigrafia preoperatorie permite identificarea nodulilor santinelǎ si planificarea locului in care se va efectua incizia.
Tehnica cu blue dye faciliteazǎ vizualizarea nodulilor santinelǎ in timpul operatiei si a fost imbunǎtǎtitǎ prin utilizarea intraoperatorie a unei sonde de detectie a radiatiilor gamma. La toate pacientele la care s-au folosit ambele tehnici, nodulul colorat corespunde nodulului "fierbinte" (cel care a captat substanta de contrast la scintigrafie), acelasi nodul fiind identificat intraoperator cu ajutorul sondei cu detectie gamma.(33) Cu ajutorul limfoscintigrafiei se vizualizeazǎ preoperator numǎrul si localizarea potentialilor noduli santinelǎ, care vor necesita biopsie. S-a sugerat, de asemenea, importanta volumului de izotop injectat in obtinerea unei identificǎri scintigrafice cu succes a nodulului santinelǎ.(40)
Intr-un studiu efectuat pe 37 paciente, Pijpers si colab. (51) au observat cǎ nu au existat efecte secundare ale injectǎrii tarsorului la nici una dintre paciente. Dupǎ 18 ore la limfoscintigrafie au observat captarea in axilǎ a substantei de contrast la 34 din cele 37 de paciente. La 27 (79%) dintre acestea substanta s-a acumulat doar intr-un singur nodul, la 11 (32%) pe langǎ nodulul santinelǎ a mai fost observat incǎ un "fals" nodul. La 6 paciente s-au vizualizat cate 2 noduli, iar la 5 paciente s-a observat drenajul in lantul mamar intern ipsilateral. La 3 paciente nu s-au evidentiat noduli santinelǎ, la una dintre aceste paciente s-a putut vizualiza doar lantul parasternal.
Interferentele date de depozitele de radiofarmaceutice, sau de activitatea limfaticǎ nodalǎ din portiunea inferioarǎ a axilei pot fi combǎtute prin modificarea pozitiei sanului cǎtre medial si achiztionarea imaginilor anterior sau lateral. La 9 paciente, proiectia lateralǎ a fost superioarǎ celei anterioare.
Compararea imaginilor luate la 2 h si la 18 h a arǎtat cǎ localizarea si numǎrul nodulilor erau neschimbate la toate pacientele in afarǎ de una, la care nodulul santinelǎ a apǎrut doar la 18 h de la injectare, la 2 paciente nu s-a observat captarea trasorului nici dupǎ cele 18 ore. Cǎile de drenaj de la locul injectǎrii cǎtre axilǎ au fost observate la 3 pacienti dupǎ 2 h de la injectare.
Preoperator sonda gamma a localizat nodulii limfatici etichetati la 30 din cele 34 de paciente, restul nefiind detectati datoritǎ continutului radioactiv scǎzut. La disectia axilarǎ a nodulilor limfatici, au fost recuperati toti nodulii vizualizati scintigrafic, nici un alt nodul nemaifiind gǎsit cu ajutorul sondei de detectare a radiatiilor gamma. Cele 53 de mostre radioactive biopsiate (0,5-1cm) au continut 69 de noduli limfatici la examinarea histologicǎ. 11 mostre aveau mai mult de un singur nodul. Nodulii santinelǎ contineau metastaze la 11 paciente, dintre care la 7 nodulul santinelǎ a fost singurul care a continut tumora, la restul de 4 paciente gǎsindu-se intre 1 si 3 noduli suplimentari afectati de metastaze. Nu au fost evidentiati noduli santinelǎ falsi negativi
Intr-un studiu efectuat intre anii 1994-1997 si cuprinzand 128 femei si 2 bǎrbati Borgstein si colab. (10) au obtinut urmǎtoarele date: la scintigrafie substanta de contrast s-a acumulat in nodulii limfatici la 116 (89%) din cei 130 pacienti, 90 dintre acestia avand un singur nodul, 24 au avut 2 noduli si 2 pacienti au avut 3 noduli. Numǎrul nodulilor axilari nu a fost afectat de localizare sau de mǎrimea tumorii primare. Rǎspandirea substantei de contrast cǎtre a doua statie ganglionarǎ fost observatǎ la 51 (44%) din cei 116 pacienti, la 37 pacienti fiind observat un nodul nonsantinelǎ, si la 14 pacienti 2-4 noduli sateliti au fost vizualizati
Indiferent de cadranul in care era localizatǎ tumora principalǎ, drenajul principal era cǎtre axilǎ. La 21 (16%) pacienti a fost observartǎ drenarea in lantul mamar intern ipsilateral, si de asemenea s-a observat drenajul limfatic parasternal in cazul tuturor localizarilor cu o variatie de la 31% in cazul tumorilor situate in cadranul supero-intern la 8% in cazul tumorilor localizate in cadranul supero-extern.
La 12 pacienti nu a fost posibilǎ vizualizarea scintigraficǎ a nodulilor limfatici datorita unei biopsii perecedente la 8 din cei 12, unui hematom de dimensiuni foarte mari rezultat in urma unei punctii biopsii la 1 pacient, si artefactelor de la locul injectǎrii la 2 pacienti. Rata de esec a detectiei nodulilor santinelǎ cu ajutorul scintigrafiei a fost semnificativ mai mare in cazul celor 22 pacienti care au avut biopsii precedente decat in cazul a 4 pacienti din 108 care aveau o tumorǎ palpabilǎ in situ.
Berman si colab. (6) intr-un studiu pe 115 paciente au observat cǎ rata identificǎrii nodulului santinelǎ a fost de 95.2%, iar boala metastaticǎ a fost identificatǎ in 23.8% dintre pacientele incluse in studiu.
Intr-un studiu efectuat pe 117 paciente care au fost supuse biopsierii nodulului santinelǎ si disectiei axilare pentru carcinom mamar primar intre anii 1995-1998, James Kollias si colab. (37) au identificat nodulul santinelǎ preoperator cu ajutorul scintigrafiei la 74 (63.2%) din femeile incluse in studiu. 52 dintre femei au prezentat un singur nodul santinelǎ, 20 au prezentat 2 noduli si cate o pacientǎ a prezentat 3, respectiv 4 noduli. Nodulul santinelǎ a fost identificat in afara portiunii inferioare a axilei la 9 paciente. O crestere semnificativǎ in detectarea nodulilor limfatici prin scintigrafie a fost observatǎ la injectarea unui volum crescut de izotopi in san (la 77% fatǎ de 57%), crescand, de asemenea, si rata detectiei intraoperatorii (la 91 fatǎ de 76%).
Intre septembrie 1996 si iunie 1997 Liberman si colab.(42) au studiat 33 de cazuri
Examinǎrile histologice in cele 33 au arǎtat cǎ 26 erau carcinoame ductale infiltrative, 5 carcinoame mixte (infiltrativ ductal si infiltrativ lobular) si 2 cu carcinom infiltrativ lobular. Dimensiunea histopatologicǎ a carcinomului infiltrativ a fost de 0.1-1.9 cm. Tumora era prezentǎ in sanul stang la 20 de paciente si in cel drept la 13. Tumorile erau localizate in cadranul superoextern la18 (55%) paciente, in cel superointern la 7 (21%) paciente, in cel inferointern la 4 (12%) paciente si in cel inferoextern la 4 (12%) paciente.
Limfoscintigrafia preoperatorie a aratat arii de captare separate de locul injectarii la 12 (36%) paciente, la 11 dintre ele erau intre 1si 5 focare axilare iar la o pacienta cu un carcinom in cadranul inferointern exista atat un focar axilar cat si unul mamar intern.
Intraoperator au fost identificati 48 de noduli santinela la 30 (91%) din cele 33 paciente. Nodulii santinela au fost identificati prin metoda combinata(blue dye +radioizotop) la 22 (73%) din cele 30 de paciente. La 29 paciente nodulul santinela era in nivelul I din axila.
La 3(9%) paciente nodulul santinela nu a putut fi identificat.Toate cele 3 au fost supuse localizarii cu ac, injectarii intraparenchimatoase a radioizotopului si injectarea colorantului.Analizele histologice au aratat carcinom infiltrativductal la toate cele 3 femei
Disectia axilara la aceste 3 paciente a aratat inexistenta tumorii la 2 paciente si existenta tumorii in 4 din cei 16 noduli limfatici la cea de a treia.
Nodulii santinela au fost liberi de tumora la 23 (77%) din cele 30 de paciente. Disectia axilara la restul de 7 paciente cu tumora in nodulul santinela nu a descoperit existenta altor metastaze la 6 (86%) dintre ele, o pacienta avand insa inca un nodul metastazat
Un numar de 178 de noduli nonsantinela a fost excizat de la cele 30 de paciente
Carcinomul a fost prezent in 7(15%) din cei 48 de noduli santinela si in unul(0.6%) din cei 178 de noduli nonsantinela(p<0.01). Pacienta cu metastaza in nodulul nonsantinela avea metastaza si in cel santinela
Uren (59) a studiat 32 cazuri prin limfoscintigrafie cu sulfur antimoniu si a observat drenajul axilar ipsilateral in 85% din cazuri. Totusi, multiplicitatea si variabilitatea tipurilor de drenaj a fost neasteptatǎ. 28% din paciente cu tumori in cadranul extern au prezentat un drenaj atipic in nodulii limfatici mamari interni, in timp ce 33% din tumorile localizate in cadranele interne au prezentat drenaj axilar. Astfel, o treime din pacientii cu tumori lateralizate au prezentat drenaj in partea medialǎ. 20% din pacientii cu tumori in cadranul superior au prezentat drenaj direct in nodulii supra- sau infraclaviculari. La un pacient, s-a identificat un nodul "in tranzit" situat in parenchimul mamar, intre leziunea primarǎ si axilǎ. Acesta era, de fapt, nodulul santinelǎ, care continea boala metastaticǎ. Disectia axilarǎ standard nu ar fi identificat acest nodul si, in consecintǎ, tratamentul adjuvant sistemic nu ar fi fost aplicat.
Borgstein si colab. (10) in studiul lor au detectat intraoperator cu ajutorul sondei gamma noduli santinelǎ la 122 pacienti (94%). O medie de 1.2 noduli a fost biopsiatǎ per pacient: 99 pacienti (81%) au avut un singur nodul santinelǎ, 22 (18%) au avut 2 noduli si un pacient a avut 3 noduli santinelǎ. Localizarea tumorii primare nu a influentat dispozitia nodulilor santinelǎ. La 40 pacienti au fost excizati nodulii nonsantinelǎ secundari, cu o medie de maxim 2 noduli per pacient.
In total un numǎr de 185 de noduli radioactivi au fost recoltati de la cei 122 pacienti.
Eary si colab.(21) au efectuat un studiu pe 62 pacienti. Numarul mediu de noduli excizati in timpul disectiei axilare a fost de (4-40). 42% paciente au avut noduli pozitivi cu o medie de 3.7 noduli per pacienta. La pacientii care nu au avut interventii anterioare 41% au avut noduli santinela pozitivi, la cei cu interventii anterioare 26% au avut noduli santinela pozitivi, iar cei cu chimioterapie anterioara au avut 71% noduli santinela pozitivi
Pe ansamblu rata de succes a detectiei intraoperatorii a nodulului santinela a fost de 79% (49din 62). Nodulii santinela au fost identificati prin ambele metode la 55% din paciente, prin metoda colorantului (blue dye) la 8% si prin radioizotopi la 37%.
22 dintre pacientii cu noduli santinela identificati au avut noduli ce contineau metastaze la disectia axilara. Nodulul santinela a fost pozitiv la 18 din cele 22 paciente
Rata de predictie fals negativa a metastazelor prin analiza nodulului santinela in disectia axilara a fost de 0% la cele 21 paciente fara interventii anterioare, de 6% la cei 18 pacienti cu interventii chirurgicale anterioare si de 25% la cei 12 pacienti tratati cu chimioterapie
La cele 27 de paciente la care nodulul santinela a fost explorat prin ambele metode rezultatele fals negative au fost de 7%, la cele 18 paciente explorate doar cu radioizotopi rezultatele fals negative au fost de 11%, iar la cele 4 paciente explorate doar cu colorant rara rezultatelor fals negative a fost de 0%
Kollias si colab.(37) au identificat intraoperator nodulul santinelǎ la 95 paciente (81.2%). La 66 femei a fost identificat un singur nodul, la 20 paciente au fost identificati 2 noduli, la 8 paciente- 3 noduli, iar la o pacientǎ - 4 noduli. Nodulul santinelǎ a fost identificat la 35 (68.6%) din 51 femei, care au fost examinate doar prin injectare de izotop, la 18 (94.7%) din 19 paciente, la care a fost injectat doar colorantul (blue dye) si la 42 (89.4%) din 47 femei la care au fost folosite ambele metode de detectie a nodulului santinelǎ.
Berman si colab. (6) intr-un studiu pe 115 paciente au observat 27.6 % din nodulii santinelǎ erau colorati si "fierbinti", 40.2% erau doar "fierbinti", 32.2% au fost doar colorati.
Dintre nodulii santinelǎ, 4.6% erau prezenti la pacienti cu DCIS, 16% la pacienti care aveau cancer in stadiul T1a si T1b, 32.8% aveau cancer in stadiul T1c, 40.8% aveau cancer in stadiul T2 si 75% din pacienti aveau cancer in stadiul T3. (17)
Tanis si colab.(56) au efectuat intre noiembrie 2000 si octombrie 2001 un studiu pe 25 de paciente cu un diagnostic clinic de cancer mamar in stadiul T1N0 sau T2N0 au gǎsit urmǎtoarele rezultate.
Rata vizualizǎrii la limfoscintigrafia preoperatorie de rutinǎ a fost de 100% (cel putin un nodul santinelǎ a fost gǎsit la toti cei 25 pacienti).
Un numǎr total de 50 de noduli au fost observati in 34 de bazine limfatice cu o medie de 2 noduli per pacient (1-5) si o medie de 1.5 noduli per bazin (1-3). Vizualizarea din pozitie lateralǎ a avut o valoare aditionalǎ la 8 (32%) din cele 25 de cazuri.
Drenajul limfatic cǎtre axilǎ exclusiv a fost observat in 17 (68%) cazuri. 7 paciente au avut drenaj atat in axilǎ cat si in bazinele nonaxilare: la 5 paciente in lantul mamar intern, in fosa infraclavicularǎ la o pacientǎ si in lantul mamar intern si fosa infraclavicularǎ la altǎ pacientǎ.
Toti nodulii "fierbinti" din axilǎ, lantul mamar intern si fosa infraclavicularǎ au fost localizati intraoperator cu o sondǎ gamma. Doi noduli santinelǎ mamari interni au fost localizati in spatele unei coaste si nu au fost extrasi. Nodulii santinelǎ paramamari nu au putut fi mǎsurati separat datoritǎ faptului cǎ au fost prea aproape de locul injectǎrii pentru a putea fi identificati. La douǎ paciente un nodul santinelǎ aditional a fost gǎsit cu ajutorul colorantului (blue dye).
Metastaze au fost gǎsite in nodulii axilari la 13 (52%) din cele 25 paciente. La una dintre ele un nodul ferm fara captare radioactivǎ sau de colorant a fost excizat fiind pozitiv pentru carcinom, in timp ce nodulul santinelǎ a fost negativ. La aceastǎ pacientǎ au mai fost gǎsite 2 metastaze nodale la disectia axilarǎ.
Toti nodulii nonsantinelǎ au fost negativi
Intr-un studiu efectuat pe 200 paciente care au fost supuse biopsierii nodulului santinelǎ si disectiei axilare pentru carcinom mamar primar in anul 2001, Liberman si colab. (41) au identificat intraoperator nodulul santinelǎ la 200 din cele 200 de cazuri, indicand o ratǎ de succes de 100%. Numǎrul mediu de noduli santinelǎ gǎsiti a fost de 2, cu variatii de la 1 la 9.
In 158 de cazuri (79%) nodulul santinelǎ fost negativ si disectia axilarǎ nu a mai fost executatǎ. La 3 paciente (1.5%), nodulul santinelǎ a fost negativ, dar nodulii nonsantinelǎ au fost suspicionati la palparea intraoperatorie, au fost excizati si s-a demonstrat existenta cancerului prin analiza sectiunilor inghetate. Disectia nodulilor limfatici axilari a descoperit metastaze axilare aditionale la toate cele 3 cazuri.
39 paciente au avut noduli santinelǎ pozitivi (19.5%), la 22 (56%) dintre acestea tumora a fost evidentiatǎ prin analiza sectiunilor inghetate, la 3 (8%) s-a efectuat analiza cu parafinǎ si la 14 (36%) s-a efectuat analiza imunohistochimicǎ dupǎ ce analiza sectiunilor inghetate si examinarea cu parafinǎ fuseserǎ negative.
Disectia limfaticǎ axilarǎ a fost efectuatǎ la 31 din cele 39 paciente cu metastaze in nodulul santinelǎ , fiind descoperite metastaze in nodulii nonsantinelǎ la 7 (23%) din care 4 (19%) la cele 21 paciente examinate prin sectiuni inghetate, 1 (33%) la cele examinate cu parafinǎ si la 2 (14%) din pacientele examinate imunohistochimic.
Intr-un studiu efectuat pe 332 paciente impǎrtite in 2 grupuri(I-83 si al II lea 249 paciente) care au fost supuse biopsierii nodulului santinelǎ si disectiei axilare pentru carcinom mamar primar intre anii 1998-2000 Bauer si colab. (4) au observat cǎ rezultatele in urma limfoscintigrafiei au fost oarecum asemǎnǎtoare pentru cele 2 grupuri.
Limfoscintigrafia a identificat cu succes nodulul santinelǎ la 51 (85%) din 60 pacinte din primul grup si la 144 (88%) din 163 paciente din grupul 2.
37 (62%) paciente din primul grup si 111 (68%) paciente din al doilea grup aveau doar drenare spre axilǎ. 50 (83%) paciente din primul grup si 138 (85%%) paciente din al doilea grup aveau drenare in axilǎ, cu sau fǎrǎ implicarea altor grupe ganglionare.
11 (18%) paciente din primul grup si 24 (15%) paciente din al doilea grup aveau drenare in nodulii mamari interni, cu sau fǎrǎ implicarea altor grupe ganglionare
Intraoperator, au fost identificati noduli santinelǎ la 79 (95%) din 83 paciente din grupul 1 si 241 (97%) din 249 paciente din grupul 2. Numǎrul mediu de noduli identificati a fost de 2.4 (0-9) in primul grup si de 2.5 (0-11) in al doilea grup.
Prin metoda combinatǎ (blue dye si izotopi) s-au evidentiat nodulii santinelǎ la 69 (83%) din 83 paciente din grupul 1 si 217 (87%) din 249 paciente din grupul 2.
Doar cu ajutorul colorantului (blue dye) au fost identificate 1 (1%) paciente din grupul 1 si 18 (7%) din grupul 2.
Pe ansamblu, rata identificǎrii cu succes a nodulilor santinelǎ cu ajutorul izotopilor a fost de 94 % in ambele grupuri si rata identificǎrii cu ajutorul colorantului a fost de 70 (84%) din 83 paciente ale grupului 1 si 223 (90%) din 249 paciente din grupul 2
Numǎrul pacientilor care au avut cel putin un nodul santinelǎ (rata concordantei) a fost de 69 (87%) din 79 paciente in primul grup si de 217 (90%) din 241 paciente din grupul 2.
13 paciente din primul grup si 10 paciente din grupul 2 au avut carcinom invaziv si noduli santinelǎ negativ, fiind supuse disectiei axilare, dar nu s-au evidentiat metastaze.
La un control efectuat in medie dupǎ 28 de luni (14-40 de luni) nu s-au gasit recurente metastatice axilare la nici una din cele 332 paciente.
Intr-un studiu efectuat pe o perioada de 18 luni, pe 916 paciente din care 516 (53%) care au fost supuse limfoscintigrafiei preoperatorii, in anul 2001 Dupont si colab. (20) au observat cǎ: din cele 516 paciente cu cancer mamar, 335 (65%) aveau noduli santinelǎ, la 181 (35%) paciente nu s-a putut pune in evidentǎ nodulul santinelǎ preoperator. La 153 (84.5%) paciente din cele 181 s-a putut observa intraoperator cu ajutorul sondei de detectie a radiatiilor gamma existenta unui nodul santinelǎ. Acest lucru a fost posibil datoritǎ sensibilitǎtii mult mai mari a unei sonde de detectie a radiatiilor gamma plasatǎ la nivelul nodulilor axilari intraoperator, fatǎ de sensibilitatea camerei de scintilatie.
Un nodul extraaxilar sau mamar intern a fost detectat la 52 (10% ) paciente folosind metode imagistice preoperator. Din aceste 52,45 (87%) aveau drenaj atat in axilǎ, cat si in nodulii mamari interni. 7 (13%) paciente aveau drenaj doar in nodulii mamari interni.
Localizǎrile extraaxilare nu au fost excizate de rutinǎ.
A existat un numǎr de 28 paciente (15.4%) la care nu s-a putut evidentia prin tehnici imagistice preoperator nici un nodul santinelǎ si nu de asemenea nu s-a putut evidentia existenta nodulului santinelǎ nici intraoperator indiferent de tehnica folositǎ. Toate aceste paciente (5% din intregul grup) au fost supuse unei disectii axilare stadiul 1 si 2 si in urma acestei examinǎri s-a demonstrat existenta metastazelor in axila la 13 paciente (46%). Utilizand tehnica combinatǎ (blue dye si radioizotopi) si o sondǎ gamma intraoperator, rata identificǎrii nodulilor santinelǎ a fost de 82%.
Borgstein si colab. (10) au obtinut urmǎtoarele date: o valoare a ratei rezultatelor fals negative de 1.7%(1 din 60), sensibilitatea a fost de 98% iar valoarea predictivǎ negativǎ a fost de 98%.
Giuliano si colab. afirmǎ cǎ nodulul santinelǎ poate prezice corect statusul axilar in 96% din biopsiile efectuate corect . (26)
Krag si colab. (40), intr-un studiu efectuat pe 18 paciente au sesizat o acuratete de 100% in detectarea nodulilor santinelǎ cu ajutorul unei sonde gamma si a 99mTc.
Kollias si colab.(37) au constatat cǎ din 95 de paciente la care a fost identificat nodulul santinelǎ, 31 (32.6%) aveau metastaze tumorale in nodulii axilari. Implicarea tumoralǎ a nodulului santinelǎ a fost demonstratǎ la 29 (93.5%) din cele 31 femei, cu o ratǎ fals negativǎ de 5%. Nodulul santinelǎ a fost singurul nodul pozitiv la 13 (41.9%) din 31 femei. Din cele 66 femei cu nodul santinelǎ negativ, 64 (97%) nu au prezentat metastaze in nodulii limfatici axilari. Din cele 22 femei, la care nodulul santinelǎ nu a fost identificat intraoperator, 6 (27.2%) au avut metastaze dovedite histologic in urma disectiei nodulilor axilari.
Veronesi si colab.(61) au publicat in 2005 rezultatele obtinute dupǎ urmǎrirea unui lot de 953 de paciente, investigate intre anii 1996 si 2000, care au avut noduli santinelǎ negativi, nefiind supuse deci disectiei axilare. Scopul studiului a fost de a urmǎri pe un numǎr semnificativ pacienti care nu au fost supusi unei disectii axilare, deoarece nodulul santinelǎ fost negativ, aparitia unor metastaze axilare evidente la aproximativ 7 ani de la prima consultatie.
Pe parcursul observatiei au avut loc 55 (5.77%) de evenimente nefavorabile in randul celor 953 pacienti astfel: 12 (21%) paciente au prezentat recurente locale, 5 (9%) paciente au dezvoltat cancer in sanul contralateral, 3 (5.45%) paciente au prezentat metastaze axilare, 22 (40%) paciente metastaze la distantǎ si la 13 (23%) a fost descoperit carcinom primar.
Indicele cumulativ estimat al metastazǎrii axilare a fost foarte scǎzut 0.43+/-0.26%. Numǎrul de evenimente observate 3 (0.31%) a fost semnificativ sub valoarea asteptatǎ. Luand in considerare si alte evenimente nefavorabile au existat 12 recurente locale in sanul ipsilateral, 5 cazuri de carcinom primar contralateral, si 2 cazuri de metastaze supraclaviculare, 20 (2%) de cazuri au dezvoltat metastaze la distantǎ(7 osoase si 13 tumori primare in diferite organe).
Au existat 6 decese, 5 datorate metastazelor si unul datoritǎ bolilor intercurente, iar rata mortalitǎtii la 5 ani a fost de 1.4+/-0.6% .
Datele rezultate in urma acestui studiu aratǎ rezultate excelente in controlul bolii si supravietuirea generalǎ. Rata foarte scǎzutǎ a metastazelor la distantǎ (3.7%) sugereazǎ cǎ pǎstrarea tesutului imun sǎnǎtos are rezultate benefice.
O altǎ observatie interesantǎ a fost rata micǎ a metastazelor axilare ipsilaterale (3 cazuri 0.3%) fatǎ de cea asteptatǎ (13 cazuri), lucru ce contrasteazǎ cu aparitia metastazelor la distantǎ (22 cazuri).
Studiile asupra nodulilor santinelǎ au raportat o medie a rezultatelor fals negative de aproape 7% (0-22%), identificand totodatǎ si cativa factori care pot reduce aceste rezultate fals negative. S-a observat cǎ rata rezultatelor fals negative scade o datǎ cu acumularea experientei. Cody si colab. (16) au raportat ca din 104 paciente care au avut o biopsie a nodulului santinelǎ, urmatǎ de disectie axilarǎ rata fals negativǎ a fost de 10.6%, dar eliminand primii 6 pacienti din primii 15 ai fiecǎrui chirurg rata rezultatelor fals negative a scǎzut la 5.2% si respectiv la 2%. Tot el a observat scǎderea ratei rezultatelor fals negative dacǎ se folosesc ambele metode (blue dye si radioizotopi) decat dacǎ se foloseste fiecare metodǎ individual.
De asemenea palparea intraoperatorie a nodulilor ajutǎ la scǎderea rezultatelor fals negative, deoarece unii noduli invadati de tumorǎ pot sǎ nu mai capteze agentul de contrast sau radioizotopul. Analiza imunohistochimicǎ reduce si ea rata rezultatelor fals negative de la 8% la 3%.
Pǎrerea generalǎ este cǎ majoritatea carcinoamelor de san apar in cadranul supero-extern, astfel incat drenarea se va face in axilǎ si doar tumorile situate cel mai medial se vor drena in lantul mamar intern. (6)
Intr-un studiu publicat in 2002 Galimberti si colab. (24), pe un lot de 160 paciente la care s-a efectuat limfoscintigrafie, au observat drenajul cǎtre lantul limfatic mamar intern la 12 cazuri (8.2%), spre lantul mamar intern si axilǎ la 82 cazuri (55.8%) si doar spre axilǎ la 53 cazuri (36%), iar la 13 cazuri nu s-a identificat implicarea nodulilor limfatici. Din cele 160 de cazuri, 146 (91.2%) au avut nodulii mamari interni negativi din care 45 au prezentat noduli axilari pozitivi, iar la 101 nodulii axilari au fost de asemenea negativi, la 14 (8.8%) paciente s-au descoperit metastaze in nodulii mamari interni. In 4 din cele 14, axila sau nodulii limfatici axilari au fost negativi, iar in 10 cazuri axila a fost pozitivǎ (6 cazuri cu un singur nodul, un caz cu 2 noduli, un caz cu 3 noduli, un caz cu 5 noduli si un caz cu 26 noduli limfatici axilari pozitivi). Patru paciente au avut micrometastaze in nodulii mamari interni. Nodulii implicati au fost extrasi din spatiul al 2-lea intercostal la 9 din cele 14 paciente, din primul spatiu intercostal la un o pacientǎ, si din al patrulea spatiu intercostal la 4 paciente. Dintre cele 10 paciente care aveau atat noduli mamari interni pozitivi, cat si noduli axilari pozitivi, nodulul santinelǎ a fost singurul nodul axilar pozitiv la 6 dintre ele. Toate cele 14 paciente cu metastaze in nodulii lantului mamar intern au fost supuse radioterapiei.
Disectia completǎ a nodulilor apartinand lantului mamar intern este o metodǎ agresivǎ care nu aduce nici o imbunǎtǎtire prognosticului. Veronesi si colab. (62) au descoperit cǎ supravietuirea este semnificativ diminuatǎ in cazul in care sunt implicati atat nodulii lantului mamar intern, cat si cei axilari. Tot el a observat cǎ dacǎ injectarea se face superficial, preluarea substantelor injectate in nodulii mamari interni este rarǎ.
Rǎmane totusi incert dacǎ radioterapia poate imbunǎtǎti supravietuirea in cazul pacientilor cu nodulii mamari interni pozitivi.
Obtinerea de informatii despre implicarea nodulilor limfatici din lantul mamar intern are 2 implicatii: prima ar fi cǎ este rezonabil sǎ se indepǎrteze nodulii limfatici axilari dacǎ nodulul santinelǎ este pozitiv, apoi este recomandat sǎ se iradieze nodulii latului mamar intern cand acestia sunt pozitivi in speranta cǎ vor fi distruse si alte metastaze din lantul mamar intern; a doua ar fi cǎ nodulii lantului mamar intern implicǎ un prognostic mai rǎu, o schema chimioterapeuticǎ mai agresivǎ (bazatǎ pe antracilina)
Oportunitatea disectei lantului ganglionar mamar intern se dezbate intens in mediul chirurghical incǎ de acum un secol. Ideea disecǎrii acestui lant ganglionar ii apartine lui Harvey Cushing in 1898.
Interesul pentru evaluarea lantului mamar intern a crescut in ultimul timp odatǎ cu acceptarea la scarǎ largǎ a cartografierii limfatice si a biopsiei nodulilor santinelǎ in cancerul de san. Spre deosebire de interventiile radicale din trecut, biopsierea nodulilor santinelǎ din lantul mamar intern, tehnica actualǎ are o morbiditate foarte micǎ, iar descoperirile pot avea un rol important in prognostic si tratament. Metastazele lantului mamar intern sunt, de asemenea, clasificate utilizand standardul American Joint Commission on Cancer in : N1, N2, N3 in functie de tipul tumorii si metoda de detectie.(11)
S-a dovedit cǎ pacientii cu noduli axilari negativi si noduli mamari interni pozitivi au un prognostic similar cu pacientii care au noduli axilari pozitivi si cei mamari interni negativi, iar in cazul existentei metastazelor in ambele statii ganglionare s-a observat un prognostic foarte scǎzut.
S-a stabilit contrar vechilor prezumtii cǎ drenarea cǎtre nodulii mamari interni nu are loc doar in cazul tumorilor din cadranul medial. Toate regiunile sanului pot drena cǎtre lantul mamar intern in mod frecvent.
Utilizand aceastǎ tehnicǎ, pacientii pot avea un tratament individualizat in functie de gradul afectǎrii, fie cǎ acesta se referǎ la terapia cititoxicǎ sistemicǎ, disectie axilarǎ completǎ sau iradierea lantului mamar intern.
Preluarea radiofarmaceuticului depinde in mare mǎsurǎ de dimensiunile particulelor (7), astfel absorbtia unor particule de dimensiuni mari (99m Tc sulfur coloidal, Ø mediu=200nm, 50-1000nm) este inceatǎ, iar slaba captare in interiorul nodulilor poate duce la neobservarea tuturor nodulilor santinelǎ. Pe de altǎ parte particulele de dimensiuni mici (99mTc antimony trisulphide colloid, Ø= 3-12nm) migreazǎ rapid prin nodulii santinelǎ cǎtre nivelurile superioare, existand riscul de a fi marcati in exces nodulii nonsantinelǎ (59).
Majoritatea studiilor au dovedit cǎ 99m Tc albumin colloidal pare a avea dimensiunea idealǎ aproximativ 80 nm, combinand absorbtia si transportul rapid cu o retinere mai indelungatǎ in nodulii santinelǎ, permitand vizualizarea cu acuratete chiar si dupǎ 24 de ore.
Drenarea limfaticǎ depinde si de tipul de tesut implicat, pare a fi relativ scǎzutǎ in tesutul mamar parenchimatos imbǎtranit fatǎ de drenarea din tesutul intradermic.
De asemenea drenarea limfaticǎ este afectatǎ si de factori mecanici, cum ar fi tesuturi cicatriceale, tumori, punctii biopsii anterioare. Obstructia distalǎ a limfaticelor de cǎtre o metastazǎ tumoralǎ, va determina drenarea limfei pe cǎi alternative, ceea ce poate duce la biopsierea unui nodul marcat incorect ca fiind nodul santinelǎ.In acelasi mod drenarea cǎtre lantul mamar intern, creste in momentul in care drenarea fiziologicǎ cǎtre axilǎ, este impiedicatǎ de metastaze extinse.(30)
In ultimul rand procesul de captare al radiofarmaceuticului este influentat si de integritatea arhitecturalǎ si fiziologicǎ a nodulului limfatic. Activitatea fagocitarǎ intensǎ determinatǎ de un posibil rǎspuns imunologic la un antigen tumoral poate duce initial la o preluare mai intensǎ. O scǎdere progresivǎ a captǎrii va avea loc pe mǎsurǎ ce tesutul normal este inlocuit de tesutul tumoral. Transformarea metastatica a nodulului limfatic va duce in final la o obstructie mecanicǎ cu absenta consecutivǎ a preluǎrii trasorului.
Nodulii limfatici hiperplazici si cei care prezintǎ degenerescentǎ grǎsoasǎ vor avea o preluare redusǎ a trasorului. (22)
In mod ironic, infiltrarea tumoralǎ extensivǎ a primului nodul aflat in calea drenǎrii (nodulul santinelǎ) este cea mai de temut capcanǎ a biopsierii nodulului santinelǎ, doarece datoritǎ redirectionǎrii limfei pe cǎi alternative, nodulii alternativi pot fi etichetati ca si noduli santinelǎ datoritǎ captǎrii trasorului, crescand astfel riscul biopsiilor fals negative.
Existǎ cateva conditii necesare pentru a permite identificarea si localizarea cu acuratete a nodulilor santinelǎ cu ajutorul limfoscintigrafiei si a sondei de detectie a radiatiilor gamma. Se considerǎ cǎ o acumulare focalǎ axilarǎ clarǎ si persistentǎ, vizibilǎ pe limfoscintigrafie, demonstreazǎ o functionalitate adecvatǎ si o stocare suficientǎ a trasorului. Aceasta garanteazǎ o detectare eficientǎ a nodulului santinelǎ corect cu ajutorul sondei gamma, cu un risc minim de biopsie fals negativǎ.(8)
Desi la majoritatea pacientilor limfoscintigrafia preoperatorie nu este esentialǎ, ea oferǎ totusi informatii despre existenta tiparelor de drenaj limfatic si numǎrul nodulilor axilari marcati cu trasor, putand preciza la care pacienti biopsia nodulului santinelǎ poate esua sau poate fi lipsitǎ de acuratete.(12)
Unul dintre avantajele majore ale biopsiei nodulului santinelǎ este absenta aproape totalǎ a complicatiilor post operatorii(40). Prin contrast disectia axilarǎ totalǎ e insotitǎ de dureri postoperatorii, limitǎri ale miscǎrii bratului, limfedem. Pe langǎ imbunǎtǎtirea calitǎtii vietii, un alt avantaj al acestei tehnici este costul relativ scǎzut datoritǎ reducerii timpului operator si a posibilitǎtii efectuǎrii in anestezie localǎ.
Concluzii
1. Limfoscintigrafia este o tehnicǎ simplǎ, neinvazivǎ cu un grad de iradiere redus ce oferǎ oportunitatea unicǎ de a identifica tiparele drenǎrii limfatice proprii fiecǎrei leziuni maligne .
2. Cunoasterea principiilor limfoscintigrafiei este esentialǎ pentru intelegerea mecanismului de identificare a nodulului santinelǎ, dar si pentru explicarea problemelor inerente de tehnicǎ.
3. Cel mai important factor prognostic in cancerul mamar incipient este statusul axilar si detectarea metastazelor nodale, pe acestea bazandu-se recomandarea terapiei adjuvante dupǎ operatie.
4. Tintirea selectivǎ si retinerea nodalǎ prelungitǎ a 99mTc coloidal sunt trǎsǎturi atrǎgǎtoare pentru identificarea nodulilor santinelǎ si permit cronometrarea flexibilǎ a interventiei chirurghicale.
5. Indepǎrtarea chirurgicalǎ si evaluarea histopatologicǎ a nodulilor santinelǎ rǎmane singura cale precisǎ de a determina implicarea lor in procesul tumoral.
6. Disectia axilarǎ reduce riscul recidivei regionale a cancerului de san in axilǎ, riscul fiind in stransǎ relatie cu numǎrul nodulilor indepǎrtati.
7. Conceptul de nodul santinelǎ ar putea fi o pǎtrundere in oncologia chirurgicalǎ, substituind operatii extinse, adesea inutile, cu morbiditate considerabilǎ, prin examinarea histologicǎ a unui singur nodul limfatic.
8. Conceptul de nodul santinelǎ aplicat initial in melanomul malign este aplicabil si in cazul altor tipuri de tumori cu diferite localizǎri: ochi, esofag, tiroidǎ, orofaringe, tractul gastrointestinal, tractul urogenital (prostatǎ).
9. Pacientii cu noduli santinelǎ in lantul mamar intern, pot avea un tratament individualizat in functie de gradul afectǎrii, fie cǎ acesta se referǎ la terapia citotoxicǎ sistemicǎ, disectie axilarǎ completǎ sau iradierea lantului mamar intern, pacienti care altfel nu ar fi fost recunoscuti ca fiind la risc.
10. Utilizarea acestei metode permite cresterea acuratetii, scǎderea morbiditǎtii, scǎderea costurilor si imbunǎtǎteste confortul pacientilor comparativ cu vechile metode.
11. Scopul final al tehnicii biopsiei nodulului santinelǎ este acela de a inlocui disectia axilarǎ completǎ ca si metodǎ de diagnostic si stadializare in cancerul de san timpuriu.
12. Cel mai important aspect in utilizarea acestei tehnici este conlucrarea dintre departamentul de medicinǎ nuclearǎ si sectia chirurgicalǎ, in spetǎ intre specialistul in medicinǎ nuclearǎ si chirurgul oncolog, rolul radiologului fiind de a oferi o stadializare cu o acuratete cat mai mare, in vederea planificǎrii tratamentului medical, chirurgical sau a trapiei adjuvante si de a monitoriza evolutia si rǎspunsul post-terapie. De asemenea, indicand chirurgului locul in care se gǎseste nodulul santinelǎ, se scurteazǎ timpul operator, suprafata zonei disecate si probabilitatea de aparitie a complicatiilor tardive.
Bibliografie
1) Ahuja A., Ying M.: "Sonography of neck lymph nodes. Part II. Abnormal lymph nodes.", Clin Radiol. 2003;58:359-366
2) Albertini J.J., Lyman G.H., Cox C., et al.: "Lymphatic mapping and sentinel node biopsy in the patient with breast cancer", JAMA, 1996;276:1818-1822
3) Baatenburg de Jong R.J., Rongen R.J., De Jong P.C., et al.: "Screening for lymph nodes in the neck with ultrasound.", Clin Otolaryngol. 1988;13:5-9
4) Bauer T.W., Spitz F.R., Callans L.S., Alavi A., Mick R., Weinstein S.P., Bedrosian I., Fraker D.L., Bauer T.L., Czerniecki B.J.: "Subareolar and Peritumoral Injection Identify Similar Sentinel Nodes for Breast Cancer", Annals of Surgical Oncology 9:169-176 (2002)
5) Bǎlǎnescu I., Blidaru Al.: "Cancerul sanului" in Angelescu N.: "Tratat de patologie chirurgicalǎ", vol. I, Editura Medicalǎ, Bucuresti, 2001:1187-1205
6) Berman C.: "Breast lymphoscintigraphy and lymphatic mapping", 2002, www.cjp.fr/vichy99/pdf/T21BERMA.pdf
7) Bergqvist L., StrandS-E., person B.: " Particle sizing and biokinetics of interstitial limphoscintigraphic agents" , Semin Nucl Med 1983:13: 9-19
8) Bilchik A.J., Giuliano A., Essner R., et al.: "Universal application of intraoperative lymphatic mapping and sentinel lymphadenectomy in solid neoplasms.", Cancer J Sci Am. 1998;4:351-358.
9) Bombardieri E., Aktolun C., Baum R.P., Bishof-Delaloye A., Buscombe J., Chatal J.F., Maffioli L., Moncayo R., Mortelmans L., Reske S.: "Breast scintigraphy: procedure guidelines for tumour imaging", Eur J Nucl Med Mol Imaging ,2003; 30:BP107-BP114
10) Borgstein P., Pijpers R., Comans E.F.I, Van Dienst P.J., Meijer S., Boom R.,: "Sentinel limph node biopsy in breast cancer: guidelines and pitfalls of lymphoscintigraphy and gamma probe detection", Journal of American College of Surgeons 1998:186:275-283
11) Breast. In: American Joint Committee on Cancer.: AJCC Cancer Staging Manual. 6th ed. New York, NY: Springer, 2002., pp 171-180.
12) Burak W.E. Jr, Waler M.J., Yee L.D., et al.: "Routine preoperative lymphoscintigraphy is not necessary prior to sentinel node biopsy for breast cancer.", Am J Surg. 1999;177:445-449
13) Cabañas R.M.: "An approach for the treatment of penile carcinoma.", Cancer 1977, 39:456-466
14)
Chiappa S., Uslenghi C., Bonadonna G., Marano P., Ravasi
G.: "Combined testicular and foot lymphangiography in testicular carcinomas",
Surg Gynecol Obstet 1966, 123:10-14
15) Christensen B., Blichert-Toft M., Siemssen O.J., Nielsen S.L.: "Reliability of axillary lymph node scintiphotography in suspected carcinoma of the breast.", Br J Surg 1980, 67:667-668
16) Cody H.S., Hill A.D.K., Tran K.N., Brennan M., Borgen P.I..: "Credentialing for breast lymphatic mapping: How many cases are enough?", Ann Surg 1999;229:723 -728
17) Cox C., Haddad F., Bass S., et al.: "Lymphatic mapping in the treatment of breast cancer", Oncology, 1998;12(9):1283-1298.
18) Cox C.E., Nguyen K., Gray R.J., et al.: "Importance of lymphatic mapping in ductal carcinoma in situ (DCIS): why map DCIS?", Am Surg. 2001;67:513-521.
19) Danielsson R., Reihner E., Grabowska A., Bone B.: "The role of scintimammography with 99mTc-sestamibi as a complementary diagnostic technique in the detection of breast cancer.", Acta Radiol 2000; 41:441.445
20) Dupont E.L., Kamath V.J., Ramnath E.M., Shivers S.C., Cox C., Berman C., Leight G.S., Ross M.I., Blumencranz P., Reintgen D.S.: "The Role of Lymphoscintigraphy in the Management of the Patient With Breast Cancer", Annals of Surgical Oncology 8:354-360 (2001)
21) Eary J Mankoff D Dunnwald K Byrd D., Anderson B., Yeung R., Moe R Sentinel Lymph Node Mapping for Breast Cancer: Analysis in a Diverse Patient Group" Radiology. 1999;213:526-529
22) Fisher B., Fisher E.R.: "Barrier function of lymph node to tumor cells and erythrocytes.", Cancer 1967, 20:1907-1913
23) Fuster D., Vinolas N., Mallafre C., Pavia J., Martin F., Pons F.: "Tetrofosmin as predictor of tumour response.", Q J Nucl Med 2003; 47:58.62
24) Galimberti V., Veronesi P., Arnone P., De Cicco C., Renne G., Intra M., Zurrida M., Sacchini V., Gennari R., Vento A., Luini A., Veronesi U.: "Stage Migration After Biopsy of Internal Mammary Chain Lymph Nodes in Breast Cancer Patients", Annals of Surgical Oncology 9:924-928 (2002)
25) Gilchrist R.K.: "Fundamental factors governing lymphatic spread of carcinoma.", Ann Surg 1940, 111:630-639
26) Giuliano A.E., Haigh P.I., Brennan M.B., et al.: "Prospective observational study of sentinel lymphadenectomy without further axillary dissection in patients with sentinel node-negative breast cancer.", J Clin Oncol. 2000;18:2553-2559
27) Giuliano A.E., Kirgan D.M., Guenther J.M., et al.: "Lymphatic mapping and sentinel lymphadenectomy for breast cancer.", Ann Surg.1994;220:391-398
28) Gould E.A., Winship T., Philbin P.H., Kerr H.H.: "Observations on a 'sentinel node' in cancer of the parotid.", Cancer 1960, 13:77-78
29) Haagensen C.D.: "Lymphatics of the breast." In "The Lymphatics in Cancer." Edited by Haagensen C.D., Feind K.R., Herter F.P., Slanetz C.A., Weinberg J.A., Philadelphia: WB Saunders Company, 1972, 300-387
30) Haigh P.I., Hansen N.M., Giuliano A.E., et al.: "Factors affecting sentinel node localization during preoperative breast lymphoscintigraphy", J Nucl Med. 2000;41:1682-1688
31) Halsted W.S.: "The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894", Johns Hopkins Hosp Bull 1894, 4:297-323
32) Hellman S.: "Natural
history of small breast cancers.",
J Clin Oncol 1994, 12:2229-2234
33) Hsueh E.C., Hansen N., Giuliano A.E.: "Intraoperative lymphatic mapping and sentinel lymph node dissection in breast cancer", CA Cancer J Clin. 2000;50:279-291
34) Jakub J.W., Pendas S., Reintgen D. S.: "Current Status of Sentinel Lymph Node Mapping and Biopsy: Facts and Controversies", The Oncologist 2003;8:59-68
35) Kern K.A.: "Sentinel lymph node mapping in breast cancer using subareolar injection of blue dye.", J Am Coll Surg. 1999;189:539-545
36) Kett K., Varga G.,
Lukács L.: "Direct lymphography of the breast.",
Lymphology 1970, 1:3-12
37) Kollias J., Gill P.G.,
Chatterton B.E., Hall V.E.,
Bochner M., Coventry B., Farshid G.: "Reliability of sentinel node status in
predicting axillary lymph node involvement in breast cancer", MJA 1999; 171: 461-465
38) Kollias J., Gill P.G., Chatterton B., et al.: "Sentinel node biopsy in breast cancer: recommendations for surgeons, pathologists, nuclear physicians and radiologists in Australia and New Zealand.", Aust N Z J Surg 1999:242-251
39) Kouvaraki M.A., Shapiro S.E., Fornage B.D., et al.: "Role of preoperative ultrasonography in the surgical management of patients with thyroid cancer.", Surgery. 2003;134:946-954
40) Krag D.N., Ashikaga T., Harlow S.H., Weaver D.L.: "Development of sentinel node targeting technique in breast cancer patients.", Breast J 1998; 4: 67-74
41) Liberman L., Cody H. S., Hill A., Rosen P., Yeh S.J., Akhurst T., Morris E.A., Abramson A., Borgen P., Dershaw D "Sentinel Lymph Node Biopsy after Percutaneous Diagnosis of Nonpalpable Breast Cancer" Radiology. 1999;211:835-844
42) Liberman L., Cody H.S.: "Percutaneous Biopsy and Sentinel Lymphadenectomy Minimally Invasive Diagnosis and Treatment of Nonpalpable Breast Cancer.", AJR 2001; 177:887-891
43) Lumachi F., Ferretti G., Povolato M., et al.: "Usefulness of 99m-Tc-sestamibi scintimammography in suspected breast cancer and in axillary lymph node metastases detection.", Eur J Surg Oncol 2001; 27:25259
44) Marchal G., Oyen R., Verschakelen J., Gelin J., Baert A.L., Stessens R.C.: "Sonographic appearance of normal lymph nodes.", J Ultrasound Med. 1985;4:417-419
45) McMasters K.M., Wong S.L., Martin R.C. II, et al.: "Dermal injection of radioactive colloid is superior to peritumoral injection for breast cancer sentinel lymph node biopsy: results of a multiinstitutional study.", Ann Surg. 2001;233:676-687.
46) McMasters K.M., Wong S.L., Tuttle T.M., et al.: "Preoperative lymphoscintigraphy for breast cancer does not improve the ability to identify axillary sentinel lymph nodes.", Ann Surg. 2000;231:724-731
47) Morton D.L., Wen D.R., Wong J.H., Economou J.S., Cagle L.A., Storm F.K., Foshag L.J., Cochran A.J.: "Technical details of intraoperative lymphatic mapping for early stage melanoma.", Arch Surg 1992, 127:392-399
48) Obwegeser R., Berghammer P., Rodrigues M., et al.: "A head-tohead comparison between technetium-99m-tetrofosmin and technetium-99m-MIBI scintigraphy to evaluate suspicious breast lesions", Eur J Nucl Med 1999; 26:1553.1559
49) Pendas S., Jakub J., Giuliano R., Gardner M., Bowen Swor G., Reintgen D.S.: "The Role of Sentinel Lymph Node Biopsy in Patients With Ductal Carcinoma In Situ or With Locally Advanced Breast Cancer Receiving Neoadjuvant Chemotherapy", Cancer Control, 2004;11(4):231-235
50) Papilian V.: "Anatomia omului", vol. II Ed. ALL 2004
51) Pijpers R., Meijer S., Hokestra O.S., Collet G.J., Boom A., Van Dienst P.J., Teule G.J.J.: "Impact of limphoscintigraphy and tracer kinetics on sentinel node identification with Technetium-99m-colloidal albumin in breast cancer", Journal of Nuclear Medicine 1997: 38:366-368
52) Pieterman RM, van Putten JW, Meuzelaar JJ,: "Preoperative staging of non-small-cell lung cancer with positron-emission tomography". N Engl J Med. 2000; 343:254-261.
53) Saltzman J.R..: "Section III: endoscopic and other staging techniques." Semin Thorac Cardiovasc Surg. 2003;15:180-186
54) Singletary SE, Allred C, Ashley P, et al.: Revision of the American Joint Committee on Cancer staging system for breast cancer. J Clin Oncol,2002; 20 (17): 3628-3636
55) Stǎnculeanu D.L.: "Totul despre cancerul mamar", Liga Romana de Cancer, Bucuresti, 2004, www.romaniancancerleague.org/dstanculeanu/Totul despre cancerul mamar Dr.Dana Lucia Stanculeanu.pdf
56) Tanis P. J., Renato A., Olmos V., Muller S., Nieweg O.,: "Lymphatic Mapping in Patients with Breast Carcinoma: Reproducibility of Lymphoscintigraphic Results" Radiology 2003;228:546-551
57) Tǎnǎsescu R.: "Cancerul mamar" in Nagy V.M.: "Propedeuticǎ oncologicǎ", Ed. Medicalǎ Universitarǎ "Iuliu Hatieganu", Cluj Napoca 2003:73-82
58) Torabi Maha, Aquino Suzanne L., Harisinghani Mukesh G.: "Current Concepts in Lymph Node Imaging", J Nucl Med 2004; 45:1509-1518
59) Uren R.F., Howman-Giles R.B., Thompson J.F., et al.: "Mammary lymphoscintigraphy in breast cancer.", J Nucl Med,1995;36:1775-1780
60) Vassallo P., Edel G., Roos N., et al.: "In-vitro high-resolution ultrasonography of benign and malignant lymph nodes: a sonographic-pathologic correlation.", Invest Radiol. 1993;28:698-705.
61) Veronesi U., Galimberti V., Mariani L., Gatti G., Paganelli G.,: "Sentinel node biopsy in breast cancer: early results in 953 patients with negative sentinel node biopsy and no axillary dissection" European Journal of Cancer 2005; 41: 231-237
62) Weissbach L., Boedefeld E.A.: "Localization of solitary and multiple metastases in stage II nonseminomatous testis tumor as basis for a modified staging lymph node dissection in stage I.", J Urol 1987, 138:77-82
63) Woodward WA, Strom EA, Tucker SL, et al.: Changes in the 2003 American Joint Committee on Cancer staging for breast cancer dramatically affect stage-specific survival. J Clin Oncol 21 (17): 3244-8, 2003.
64) Wunderbaldinger P., Harisinghani M.G., Hahn P.F., et al.: "Cystic lymph node metastases in papillary thyroid carcinoma.", AJR. 2002;178:693-697
65) Ying M., Ahuja A.: "Sonography of neck lymph nodes. Part I. Normal lymph nodes.", Clin Radiol. 2003;58:351-358
66) Zeidman I., Buss J.M.: "Experimental studies of the spread of cancer in the lymphatic system.", Cancer Res 1954, 14:403-405
67) "Breast Ultrasound", http://www.mayoclinic.org/breastimagingservices-jax/ breastultrasound.html, 2005
68) "Mammography", http://www.mayoclinic.org/breastimagingservices-jax/ mammography.html, 2005
69) "Breast Cancer Diagnosis", http://www.imaginis.com/breasthealth/ ultrasound.asp, 2005
70) "Axillary Dissection", http://www.breastcancer.org
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Analize pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||








