| Medicina | Medicina veterinara | Muzica | Psihologie | Retete | Sport |
Medicina
|
|
Qdidactic » sanatate & sport » medicina CERCETARI PROPRII - modularea diferentierii cardiace a celulelor stem embrionare murine cu ajutorul unor factori de crestere |
CERCETARI PROPRII - modularea diferentierii cardiace a celulelor stem embrionare murine cu ajutorul unor factori de crestere
Cercetari proprii Modularea diferentierii cardiace a celulelor stem embrionare murine cu ajutorul unor factori de crestere
1.1. Introducere
Celulele stem izolate din embrionii preimplantati sunt localizate in masa celulara interna, definite ca si pluripotente si stau la originea tuturor tesuturilor si organelor viitorului individ.
Aceste celule dupa recoltare au abilitatea de a se diferentia in vitro cu ajutorul diferitelor conditii culturale specializate in derivatele celor trei staturi embrionare murine si anume endoderm, ectoderm si mezoderm.
Liniile celulare Es se dezvolta dintr-un stadiu nediferentiat fiind asemanatoare cu celulele embrionului timpuriu, cu capacitate de diferentiere pe linie cardiogenica, miogenica, neurogenica, hematopoetica, adipogenica, condrogenica precum si in celule epiteliale, endoteliale si celule musculare netede (VSM) (Robert P. Si col., 2005, Curtis MW si col., 2009). In faza finala, celulele ESCs diferentiate prezinta proprietati farmacologice, fiziologice ale celulelor specializate: cardiomiocitele diferentiate in vitro au caracteristici tipice celulelor atriale, ventriculare, Purkinje si pacemaker-like, iar celulele neuronale sunt caracterizate prin sinapse inhibitoare si excitatoare (Wollert K.C., si col., 2005). Celulele neuronale, cardiace si VSM prezinta receptori functionali tipici pentru fiecare tip de celula.
Agregarea celulelor in sisteme tridimensionale (3D), numite si corpusculi embrionari, demonsteraza capacitatea pluripotenta a acestor celule, iar examinarea acestora in vitro poate dezlega unele mistere legate de biologia dezvoltationala si medicina regenerativa la soareci (Lee M.S., si col., 2004, Habeler W., si col., 2009
Recent utilizarea celulelor stem umane a deschis multe posibilitati pentru cercetarea bolilor cardiovasculare si utilizarea acestora in terapia regenerativa (Pal R., 2008, Dox M. X., 2008, Nicolini F., si col. 2008).
Conceptul de medicina regenerativa implica posibilitatea repararii unui tesut sau organ lezat prin injectarea de celule stem diferentiate in diferite tipuri celulare (Winkler J., si col. 2005, van Ginneken AC., si col., 2007, Li S.C., si col. 2008, Nicorescu I., si col., 2009, Smith A.M., si col. 2009
Diferentierea in vitro a celulelor ESCs permite studierea embriogenezei normale si a cardiogenezei, permitand studierea bolilor genetice cardiace si a disfunctiilor asociate.
Autoreinnoirea si mentinerea capacitatii de nediferentiere a celulelor ESCS in cultura pot fi obtinute prin mentinerea acestor celule pe fibroblasti embrionari murini (MEF) sau utilizarea LIF (leukemia inhibitory factor) (Shahrul H.Z.A., si col. 2005
Sistarea suplimentarii mediilor de cultura cu factori de crestere sau a factorilor care mentin autoreinnoirea duce la diferentierea lor in agregate multicelulare cu celule diferentiate cunoscute sub numele de EBs (Kenneth R.B., si col. 2002, Winkler J., si col. 2005).
Utilizarea acestor celule diferentiate si prediferentiate poate sa insemne remediu pentru multe boli degenerative (Oren C si col., 2006, Pelacho B., si col., 2008, Chien KR., si col., 2008, Nury D., si col., 2009
Insuficienta cardiaca este cauza principala a morbiditatii si mortalitatii pe plan mondial (Agapios Sachinidis si col., 2003, White M.J. si col., 2004, Zhang F., si col., 2008 Este o maladie plurifactoriala ce rezulta in urma unui episod de hipoxie, ischemie, hipertensiune arteriala, provocand pierderea capacitatii functionale ale cardiomiocitelor. Elucidare mecanismelor genetice intracelulare care stau la baza diferentierii cardiomiocitara a celulelor stem embrionare murine (ESCs) este o conditie foarte importanta pentru viitoarele terapii de inlocuire a celulelor cardiace nefunctionale (Doss MX si col., 2004, Iop L., 2008).
Cercetarile recente privind strategiile de diferentiere a celulelor stem pe linie cardiomiocitara si controlul expresiei genelor implicate in diferentiere au favorizat intelegerea caracteristicilor biologice, fiziologice si nu in ultimul rand procesele specific molecular implicate in diferentiere (Winkler J., si col., 2005).
In anul 2001, bolile cardiovasculare au determinat o treime din totalul deceselor la nivel mondial (Gherasim L., 2002). In acest context, Romania ocupa primul loc in lume, conform datelor statistice publicate in 2003 de Organizatia Mondiala a Sanatatii si American Heart Association. De aceea lucrarea de fata isi propune inducerea diferentierii directionate a celulelor stem embrionare murine pe linie cardiomioblastica si caracterizarea acestora prin tehnici de imunohistochimie. S-a avut in vedere inducerea agregarii celulelor in sisteme tridimensionale (3D), numite si corpusculi embrionari, demonstrand capacitatea pluripotenta a acestor celule.
1.2. MATERIALE SI METODA
Materialul biologic
Cercetarile au fost realizate in perioada octombrie 2008 - martie 2009 in cadrul disciplinei de Reproductie, Obstetrica si Ginecologie Veterinara Cluj-Napoca.
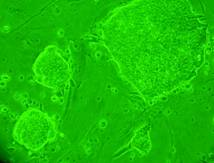
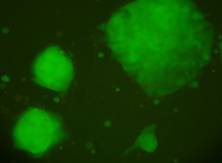
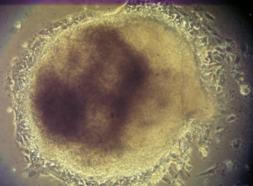
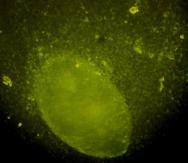
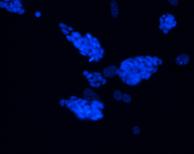
Materialul biologic utilizat pentru initierea diferentierii cardiace a fost reprezentat de linia celulara stem embrionara: linia CDE1(fig.12) obtinuta de la soareci CD1/EGFP testata pentru identificarea markeriilor caracteristici ai pluripotentei. Linia de soareci CD1/EGFP a fost obtinut din embrioni transgenici prin integrarea random a transgenului TgN(GFPU)5Nagy care contine proteina verde fluorescenta, prima data publicat ca si linia B5/EGFP (Hadjantonakis A.K., si col. 1998). Liniile celulare stem embrionare a acestor linii de soareci a fost agregata cu blastocisti proveniti de la soareci CD1(Jackson Laboratory) astfel obtinand linia CD1/EGFP care deasemenea poarta proteina verde fluorescenta.
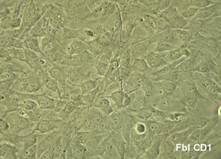
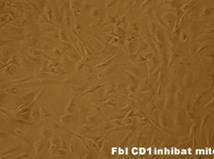
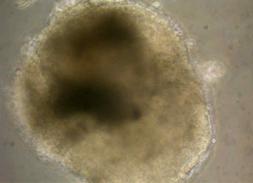
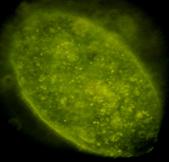
Dupa decongelare, linia celulara au fost pastrata pe monostrate de fibroblasti embrionari murini primari inhibati mitotic(fig.13), proveniti de la soareci CD1(SPF). Inainte de inducerea diferentierii, linia celulara a fost pasata de cinci ori.
|
|
|
Fig. nr 12 - Linia de celule stem embrionare murine CDE1
|
|
|
Fig.13 - Fibroblasti CD1 inhibati mitotic (40x)
Mediul de cultura (tabel nr.1) utilizat a fost mediul Knock-out DMEM (Gibco) suplimentat cu glutamax (Gibco), streptomicina (Sigma), penicilina (Sigma), β-mercaptoetanol (ME) (Sigma), aminoacizi neesentiali (Sigma), LIF (Esgro), FCS (Hyclone) si cu un amestec de medii de conditionare (preparate in laborator).
Tabel nr. 1. - Mediul de propagare pentru celulele stem embrionare murine
|
Component |
Cantitatea utilizata |
|
Knock-out DMEM |
350 ml |
|
Glutamax |
50mM |
|
Penicilina |
50U/ml |
|
Streptomicina |
50µg/ml |
|
β-mercaptoetanol |
50mM |
|
Aminoacizi neesentiali |
|
|
LIF |
1000U/ml |
|
FCS |
20% |
|
Amestec de medii de conditionare |
1:4 |
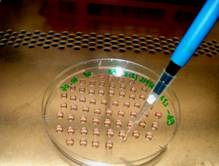

Fig. nr. 14 - Prepararea picaturilor suspendate
![]()
![]()


Fig.nr.15 - A: Agregarea celulelor in picatura suspendata, B: Agregarea celulelor in suspensie
Cu doua zile inainte de diferentiere, celulele ESCs au fost transferate pe placi Petri (Greiner) pretratate cu gelatina 0,1% (Sigma)(fig.14). Pentru inducerea formarii corpusculilor embrionari s-a utilizat agregarea celulelor in picatura suspendata (fig. 15-16).

Figura nr. 16- Prepararea corpusculilor embrionari
Dupa
detasarea coloniilor celulare si formarea suspensiei unicelulare s-a
efectuat neutralizarea tripsinei prin adaugarea mediului de cultura
cu ser fetal si s-a trecut la centrifugarea lor la temperatura de
Numar total de celule![]()
![]() .
.
Dupa calcularea numarului total de celule, s-a efectuat diluarea suspensiei celulare astfel incat 20 µl suspensie celulara (volumul unei picaturi suspendate) sa contina 800 de celule.
Pentru producerea agregatelor celulare s-au utilizat placi Petri de 100-mm, iar pentru agregarea in suspensie, placi bacteriologice de aceeasi dimensiune. Au fost realizate in total 4 placi Petri cu cate 70 de picaturi/placa. Placile astfel preparate au fost incubate la termostat la temperatura de 37˚C, in mediu imbogatit cu 5% CO2, pentru obtinerea de EBs.
Mediul de diferentiere a fost compus din: mediul DMEM/F12(Gibco) suplimentat cu 1% glutamax 100x (Gibco), 50µg/ml streptomicina (Sigma), 50U/ml penicilina (Sigma), 50mMβ-mercaptoetanol (ME), 0,1 mM aminoacizi neesentiali (Gibco), 15% FCS (Hyclone).
La mediul de cultura, s-au adaugat factorii de crestere BMP-2 6ng/ml, FGF 5ng/ml, IGF 10 ng/ml si BMP-4 in doza de 1 ng/ml. De asemenea s-au utilizat si doua amestecuri ale acestor factori de crestere, primul fiind compus din BMP-2, BMP-4, FGF, IGF, iar al doilea din BMP-2 si BMP-4 (fig.17).
In a cincea zi de diferentiere, corpusculii embrionari au fost mutati in placi gelatinizate, compartimentate, fiecare compartiment fiind prevazut cu o lamela histologica necesara colorarii imune. S-au preparat doua placi compartimentate (48 de godeuri).
Fig. nr. 17 - Protocolul de lucru
Spalarea corpusculilor embrionari formati s-a realizat dupa 48 de ore cu mediu de diferentiere, acestia fiind cultivati in doua placi Petri bacteriologice de 100-mm.
Fig.nr.18 - Corpusculi embrionari proveniti din picatura suspendata adaugate in suspensie
Cultivarea in suspensie a corpusculilor embrionari s-a realizat fara schimbarea mediului de cultura timp de cinci zile(fig.18). In a cincea zi, corpusculii embrionari au fost transferati cu ajutorul pipetei Gilson pe placi gelatinizate, multicompartimentate, prevazute cu lamele histologice sterile.
S-a repartizat cate un corpuscul embrionar /compartiment gelatinat cu 500 µl mediu de cultura. S-au utilizat in total 8 placi: patru pentru EBs obtinuti in suspensie si patru pentru EBs obtinuti din picaturi suspendate (hanging drop).
Corpusculii embrionari au fost cultivati in mediu de diferentiere suplimentat cu 1-tioglicerol. Dupa observarea contractiilor spontane, mediul a fost schimbat din 2 in 2 zile. In urma examinarii zilnice s-au intocmit tabele privind diametrul si contractiile EBs luate in studiu. Fixarea corpusculilor embrionari s-a realizat dupa 21 de zile de cultura (2d+19). Dupa inceperea contractiilor spontane, mediul de cultura a fost schimbat din 2 in 2 zile. In urma examinarii zilnice a corpusculilor embrionari s-a calculat procentajul corpusculilor embrionari cu contractii spontane si de asemenea s-a efectuat masurarea ariei de pulsatie si frecventa contractiilor.
Masurarea zonelor de contractii spontane ale corpusculilor embrionari s-a realizat prin utilizarea microscopului Nikon si a softwerul Applied Imaging Cytovision(fig.19).

Figura nr.19 - Examinarea preparatelor cu microscopului Nikon
Analiza imunohistochimica a celulelor diferentiate
Pentru identificarea potentialului cardiogenic, cat si pentru identificarea unor markeri ai pluripotentei s-a efectuat analiza imunohistochimica a corpusculilor embrionari in ziua a 21 a diferentierii.
Conform protocolului imunohistochimic, initial s-a realizat permeabilizarea celulelor pentru antigene intracelulare prin tratarea acestora cu o solutie 0,1% TRITON X-100 timp de 5 minute, iar pentru blocarea permeabilizarii s-a adaugat solutia BSA 10%. Dupa 24 de ore la temperatura de 4°C, s-a efectuat trei spalari succesive cu solutie de PBS si s-au adaugat anticorpii primari: anticorpi anti-titin (mouse IgM); anticorpi anti-cytokeratin Endo-A (mouse IgG2a); anticorpi anti-smooth muscle actin (mouse IgG2a); anticorpi anti-brachyury (Chemicon); anticorpi anti -nestin (Hibridoma) (tabel nr. 2).
Tabel nr.2 - Anticorpi pentru analiza proteinelor specifice celuare prin imunofluorescenta
|
Antigen |
Dilutia de lucru |
Sursa |
|
Titin |
1:3 |
Sigma |
|
SMA |
1:50 |
Novocastra |
|
Β III Tubulin |
1:2000 |
Chemicon |
|
Oct4 |
1:10 |
RD - SYS |
|
Brachyury |
1:10 |
Chemicon |
|
Nestin |
1:3 |
Chemicon |
|
Troma -1 |
1:3 |
Hibridoma |
Spalarea s-a realizat cu solutie PBS dupa 24 de ore la temperatura de 4°C. Dupa adaugarea anticorpilor secundari, placile au fost termostatate la 37°C timp de 1 ora. Ca si anticorpi secundari s-au utilizat: anti mouse IgM-FITC (Jackson); anti goat IgG- Cy3 (Jackson); anti mouse IgG-Cy3 (Jackson). Pentru colorarea nucleara la preparatele astfel pregatite s-au adaugat colorantul Höchst (Sigma).
Pe lamele SuperFrost tratate cu acid sulfuric crom s-au adaugat cate 2 picaturi de Vectofluor Mounting Medium (Sigma) pentru o mai buna vizualizare, iar in aceste picaturi s-au plasat lamelele histologice.
Preparatele au fost examinate imediat cu ajutorul microscopul cu fluorescenta, folosind filtrul potrivit fiecarui fluorocrom.
Pentru identificarea coloniilor alcalino-fosfataza pozitiva s-a utilizat coloratia propusa de Anna Wobus si col, imbunatatita de Gocza Elen.
1.3. Rezultate si discutii
O prima etapa indispensabila initierii diferentierii celulare este reprezentata de obtinerea corpusculilor embrionari (EBs) ( fig.20).
Dintre metodele descrise in literatura de specialitate referitoare la inducerea formarii EBs, in aceste experimente s-a recurs la doua tehnici: formarea EBs in picatura suspendata, folosind gravitatia ca o forta de agregare si respectiv.
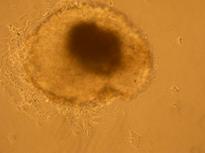
Dupa 48 de ore de cultura in picatura suspendata s-a observat formarea corpusculilor embrionari de acceasi marime, prezentand avantajul obtinerii de EBs bine calibrati, aproape identici ca forma si marime(fig.21).

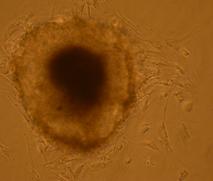
Fig.21 . - Corpuscul embrionar in picatura suspendata dupa 48 h
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
|
|
||||
|
Fig. nr.20 - EBs obtinuti din picaturi suspendate atasati pe gelatina dupa 24 de h |
|||||
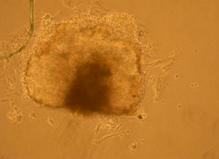
Pentru inducerea diferentierii s-au utilizat factorii de crestere: IGF, FGF, si doua amestecuri, primul format din BMP2, BMP4, FGF si IGF, iar al doilea din BMP2 si BMP4. Factorii de crestere au fost adaugati in timpul cultivarii corpusculilor embrionari in suspensie, proveniti din picatura suspendata(fig. 22).
Identificarea cardiomiocitelelor s-a realizat prin observarea aparitiei unor contractii spontane ritmice, dupa 8 zile de diferentire. S-a constatat de asemenea o crestere semnificativa a dimensiunilor corpusculilor embrionari.
|
|
|
|
|
|
|
Fig.22. - Corpusculi embrionari pe substrat de gelatina obtinuti din agregare in picatura suspendata 10xPC |
|
Aparitia contractiilor spontane a fost observata prima data in cazul corpusculilor embrionari tratati cu amestecul I si FGF (5d+3) si ulterior, odata cu inaintarea perioadei de diferentiere s-au constatat la restul Ebs.
S-au evidentiat deasemenea zone contractile localizate inconjurate de celule stralucitoare (fig. 23).
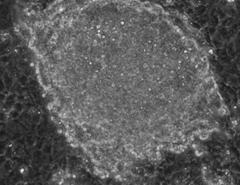
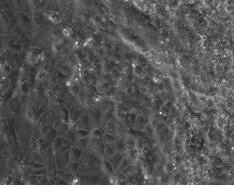
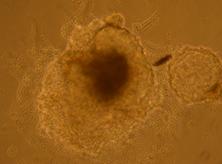
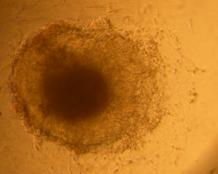
Fig. nr. 23- Corpuscul embrionar obtinut dupa cultivare in amestecul II


![]()


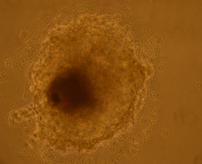
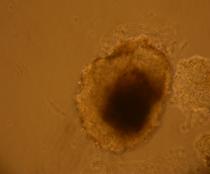
Fig. nr.24- Corpuscul embrionar tratat cu BMP2 si BMP4
La corpusculii embrionari tratati cu BMP2 si BMP4, s-au constatat contractii pe arii restranse, incercuite de un halou de celule mai stralucitoare(fig.24).
In cazul acestor corpusculi, contactiile au aparut mai tardiv, in ziua 15-a diferentierii, deoarece se cunoaste faptul ca, BMP-4 are un efect inhibitor asupra diferentierii cardiace (grafic nr.1).
In cazul corpusculilor embrionari pretratati cu IGF, contractiile caracteristice au aparut cel mai tardiv, doar in ziua a 17- a a diferentierii.
In timpul etapelor de diferentiere timpurie, celulele din EBs au prezentat o morfologie tipica descrisa si in literatura de specialitate si anume, celule mici si rotunde, cu miofibrilele neoformate imprastiate si neorganizate.
Celulele contractile sunt mononucleate, in forma bacilara si au jonctiuni intracelulare solide. In timpul etapelor de diferentiere terminale, pot fi vizualizate fascicule bine organizate de miofibrile si sarcomerele, fapt dovedit si prin coloratii imunohistochimice speciale.
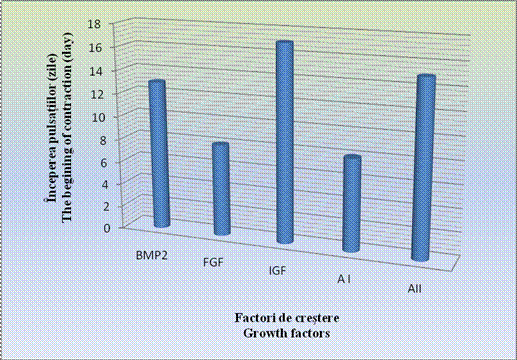
Grafic nr. 1- Inceperea contractiilor spontane dupa utilizarea factorilor de crestere
Examinarea zilnica a culturilor a indicat un procentaj maxim de 100% in ceea ce priveste contractiile spontane ale corpusculilor embrionari doar in cazul EBS tratati cu FGF. In cazul corpusculilor embrionari tratati cu amestecul II si la cei cu BMP2, s-au inregistrat contractii spontane intr-un procent usor mai redus si anume de 62,50% in cazul EBS cu BMP2 si de 75% in cazul EBS tratati cu amestecul II(grafic nr.2).
Cele mai mici procente de contractii spontane s-au inregistrat in cazul EBs tratati cu IGF, 37,50%, desi la acesti corpusculi s-au inregistrat zonele cele mai mari de contractie.
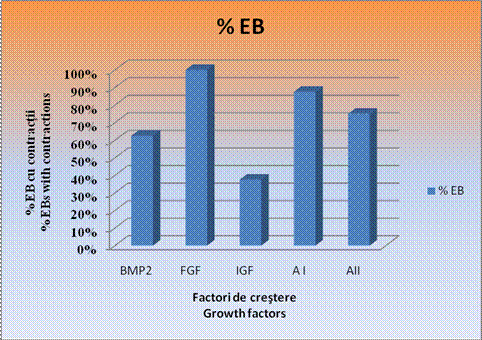
Grafic nr. 2 - Procentajul corpusculiilor embrionari care pulseaza
Examinarea si analizarea computerizata (softwerul Applied Imaging Cytovision) a corpusculilor embrionari tratati cu BMP2, IGF, FGF, amestecul I si amestecul II a permis stabilirea urmatorilor parametrii pentru zonele de contractii arie, latime, inaltime si perimetru (tabel nr.4).
Este evident faptul ca, in cazul EBs cultivati in IGF(tabel nr.6), s-au constatat cele mai mari zone de contractii, acestea fiind de 2104173,1 ± 5444,1 µm, urmate de zonele de contractie date de corpusculii cultivati in mediul de cultura cu FGF(tabel nr.5), cu o medie de 62185,91 ± 4766,0 µm si de BMP 2 cu o medie de 53859,17 ± 2314,07µm(tabel nr.3).
Zonele cele mai restranse de contractii spontane s-au inregistrat in cazul tratamentului cu amestecuri de factori de crestere. Astfel, in cazul amestecului 1, media a fost de 22029,23 ± 4207,7 µm, iar in cazul amestecului 2 de 14752,67 ± 1782,26 µm(tabel nr.7) concluzionandu-se astfel ca amestecurile de factori de crestere induc o inhibare si o intarziere a aparitiei contractiilor spontane in vitro (tabel nr.8, grafic nr.3).
Tabel nr.3 - Rezultatele obtinute in urma masurarii EBs tratati cu factorul de crestere BMP2
|
EBS-HD-BMP2 |
Tool |
Area(µm) Aria (µm) |
Boundwidth(µm) Latimea zonei |
Boundheight(µm) Inaltimea |
Perimeter (µm) Perimetrul |
|
1. |
Outline |
25 706,250 |
189,380 |
198,130 |
636,690 |
|
2. |
Outline |
24 484,570 |
167,500 |
199,380 |
662,970 |
|
3. |
Outline |
112174,410 |
480,630 |
296,250 |
1 302,670 |
|
4. |
Outline |
23 453,234 |
154,345 |
200,234 |
693,436 |
|
5. |
Outline |
22 349,023 |
143,321 |
201,230 |
721,754 |
|
6. |
Outline |
114987,306 |
498,076 |
312,765 |
1 507,520 |
Tabel nr.4 - Rezultatele obtinute in urma masurarii EBs tratati cu factorul de crestere BMP2+BMP4
|
EBS-HD-BMP2+BMP4 |
Tool |
Area(µm) Aria (µm) |
Boundwidth(µm) Latimea zonei |
Boundheight(µm) Inaltimea |
Perimeter (µm) Perimetrul |
|
1. |
Outline |
14196,480 |
220,000 |
103,130 |
539,360 |
|
2. |
Outline |
13696,290 |
120,000 |
147,500 |
432,860 |
|
3. |
Outline |
9 934,960 |
128,750 |
95,000 |
378,860 |
|
4. |
Outline |
19477,730 |
177,500 |
149,380 |
519,770 |
|
5. |
Outline |
12856,327 |
112,986 |
186,346 |
346,908 |
|
6. |
Outline |
18354,254 |
189,342 |
123,659 |
435,789 |
Tabel nr.5- Rezultatele obtinute in urma masurarii EBs tratati cu factorul de crestere FGF
|
EBS-HD-FGF |
Tool |
Area(µm) Aria (µm) |
Boundwidth(µm) Latimea zonei |
Boundheight(µm) Inaltimea |
Perimeter (µm) Perimetrul |
|
1. |
Outline |
24039,840 |
167,500 |
205,000 |
584,270 |
|
2. |
Outline |
56650,780 |
275,630 |
255,630 |
880,110 |
|
3. |
Outline |
253066,410 |
790,000 |
606,250 |
2 469,360 |
|
4. |
Outline |
7 570,120 |
118,750 |
86,250 |
379,010 |
|
5. |
Outline |
6 239,130 |
123,453 |
87,124 |
342,741 |
|
6. |
Outline |
25549,207 |
123,870 |
213,234 |
593,234 |
Tabel nr.6- Rezultatele obtinute in urma masurarii EBs tratati cu factorul de crestere IGF
|
EBS-HD-IGF |
Tool |
Area(µm) Aria (µm) |
Boundwidth(µm) Latimea zonei |
Boundheight(µm) Inaltimea |
Perimeter (µm) Perimetrul |
|
1. |
Outline |
104792,380 |
373,750 |
397,500 |
1 226,620 |
|
2. |
Outline |
39 047,850 |
225,000 |
233,750 |
730,660 |
|
3. |
Outline |
311132,810 |
619,380 |
620,000 |
2 034,310 |
|
4. |
Outline |
30 370,120 |
225,630 |
188,130 |
774,070 |
|
5. |
Outline |
116438,280 |
504,380 |
413,130 |
1 557,460 |
|
6. |
Outline |
23 256,901 |
234,987 |
168,209 |
812,641 |
Tabel nr. 7 - Rezultatele obtinute in urma masurarii EBs tratati cu amestecul 2
|
EBS-HD-MIX |
Tool |
Area(µm) Aria (µm) |
Boundwidth(µm) Latimea zonei |
Boundheight(µm) Inaltimea |
Perimeter (µm) Perimetrul |
|
1. |
Outline |
10883,200 |
128,750 |
106,880 |
449,300 |
|
2. |
Outline |
27273,440 |
198,130 |
196,250 |
716,680 |
|
3. |
Outline |
18444,920 |
162,500 |
150,630 |
505,690 |
|
4. |
Outline |
34801,560 |
289,380 |
157,500 |
726,980 |
|
5. |
Outline |
19485,160 |
186,250 |
133,130 |
527,110 |
Tabel no. 8 - Media masuratorilor efectuate pentru corpusculii embrionari tratati cu factori de crestere
|
Factori de crestere |
Aria zonelor de contractie % µm |
Latimea zonei de contractie % µm |
Inaltimea zonei de contractie % µm |
Perimetrul zonei de contractie % µm |
|
BMP2 |
53859,17 ± 2314,07 |
272,208 ± 85,99 |
234,665 ± 27,18 |
587, 506 ± 79,02 |
|
FGF |
62185,91 ± 4766,08 |
266,5338±131,63 |
242,251±95,73 |
876,1208 ± 40,20 |
|
IGF |
104173, 1± 5444,1 |
363,8545 ± 83,70 |
336,7865 ±86,84 |
1184,294 ±264,69 |
|
Amestec I |
22029,23 ± 4207,7 |
191,0433±26,95 |
154,2733±16,13 |
582,6017 ± 57,72 |
|
Amestec II |
14752,67 ± 1782,26 |
158,0963 ± 21,83 |
134,1692 ±16,94 |
442,2578 ± 37,86 |
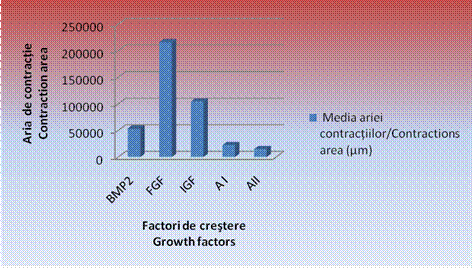
Grafic nr. 3- Reprezentarea grafica a mediilor masuraturilor efectuate pentru EBs tratati cu factori de crestere
Dupa fixarea si selectarea corpusculilor embrionari si a culturilor obtinute dupa recoltarea mecanica a zonelor cu contractii spontane, s-a efectuat analiza imunohistochimica a acestora cu utilizarea unor anticorpi speciali, cu ajutorul carora, pe langa markerii caracteristici lineajelor diferentiate, au fost detectati si markeri ai pluripotentei celulelor stem embrionare murine.
S-a constatat faptul ca diferentierea celulelor din cadrul aceluiasi corpuscul embrionar nu se produce simultan, ci treptat, de aceea la finalul experimentelor s-au observat si grupuri de celule nediferentiate (fig.25), fapt dovedit prin coloratia speciala pentru evidentierea fosfatazei alcaline (fig.26).
De asemenea au fost identificate si alte tipuri celulare cu origine din mezodermul primitiv .
|
|
|
|
Fig. 25. - Detectarea imunohistochimica a markerului celular Oct3 la corpusculii embrionari |
|
|
|
|
|
Fig.26 . - Detectarea imunihistochimica a citocheratinei Endo (Troma) |
|
|
|
|
|
Fig.27 - Evidentierea imunohistochimica a titinului sau connectinului |
|
Proteinele sarcomerice ale cardiomiocitelor provenite din celulele ESCs au stabilita dezvoltarea in urmatoarea ordine titin (fig.27) (z disck), α- actina (fig.28), miomezina, M proteina. Titinul sau connectinul este o proteina cu rol foarte important in elasticitatea sarcomerelor.
Este constituentul principal al filamentelor longitudinale care asigura mentinerea arhitecturii miofibrilelor.
Este o proteina care apare mai timpuriu in timpul diferentierii celulelor stem embrionare spre linia cardiaca urmandu-si factorul de transcriptie GATA -4.
|
|
|
|
|
|
|
|
|
|
Fig.nr.28 . - Detectarea imunihistochimica a actinei (smooth muscle actin)
Nestinul (fig.29) este o proteina intermediara filamentara de tip IV implicat in neuro- si gliogeneza. Pe langa expresia timpurie in celulele stem diferentiate pe linie neuronala, este implicat si in angiogeneza si in diferentierea pe linie endoteliala.
|
|
|
Fig. 29 - Evidentierea imunohistochimica a nestinului |
|
|
|
Fig.30 . - Evidentierea imunohistochimica a brachyury |
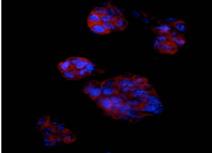
Detectarea imunohistochimica a Brachyury (fig.30) indica prezenta celulelor precursoare cardiace, este markerul care apare cel mai tardiv in timpul diferentierii cardiace.
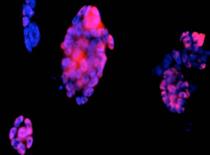
Evidentierea coloniilor fosfatazo-alcaline pozitive si a celor Oct 4 pozitive in corpusculi embrionari, arata faptul ca printre celule diferentiate sunt si celule nediferentiate, dat de faptul ca nu toate celulele au acelasi ritm de diferentiere(fig.31,32).
|
|
|
|
Fig.31 . - Evidentierea imunohistochimica a Oct ľ |
|
|
|
|
|
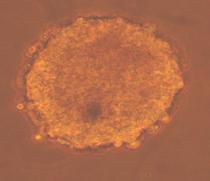
Fig.32. - Corpuscul embrionar cu zone intinse pulsatile colorat pentru fosfataza alcalina |
|
Identificarea coloniilor cytokeratina endo pozitive indica prezenta celulelor mezenchimale timpurii, iar evidentierea coloniilor βIII pozitive indica prezenta celulelor precursoare neurale (fig.33).
|
|
|
|
|
|
|
|
|
Fig. 33. - Evidentierea imunohistochimica a βIII tubulin |
||
Odata cu maturarea, cardiomiocitele provenite din celule ESCs devin alungite, cu miofibrile bine dezvoltate si cu sarcomerele vizibile.
Cardiomiocitele derivate din celulele ESCS exprima gene cardiace intr-o maniera controlata de dezvoltare, iar pentru identificarea acestora sunt necesare tehnici mai avansate de examinare.
Doetschman si col (1985) sunt primii care observa ca, celulele mES cultivate in suspensie in conditii favorabile pot forma agregate celulare numite corpusculi embrionari. Formarea acestor agregate este necesara pentru diferentierea in vitro.
Corpusculii embrionari ofera avantajul unei structuri tri-dimensionale care intensifica interactiunile celula-celula, care se pare ca sunt importante pentru anumite programe de dezvoltare si diferentiere.
Pe de alta parte, complexitatea corpusculilor embrionari poate avea si dezavantaje prin secretia unor citokine si a unor factori inducibili care pot duce la un control mai putin precis al diferentierii. In urma diferentierii directionate a celulelor din Ebs, cardiomiocitele derivate in cateva zile, incep sa se contracte spontan. Rata acestor contractii spontane se schimba dinamic.
Cardiomiocitele diferentiate complet opresc contractia, insa depinzand de conditiile culturale raman viabile mai multe luni.
Cardiomiocitele neoformate apar in exteriorul liniei epiteliale cu caracteristicile endodermului visceral si linia bazala a celulelor mezenchimale. Schimbarea morfologiei celulare din corpusculii embrionari poate fi corelata cu cele trei stadii de dezvolatare si diferentiere a celulelor: timpuriu (pacemaker- like sau celule miocardale primare), intermediar si terminal (artial, ventricular, nodal, His si celulele Purkinge). Procesele diferentierii morfologice in corpusculii embrionari (EBS) sunt urmate de schimbarea expresiei genice si proteice, dezvoltarea canalelor de ioni si receptori specifici de tesut (Thomson S., si col. 2000, Ana Wobus si col 2005, Theo K., si col. 2005).
Rezultatele noastre demonstreaza ca, diferentierea in vitro a celulelor ESCs necesita agregarea initala a acestora pentru a forma structuri, corpuri embrionare. Aceste agregate numite si corpusculi embrionari (EBs, embryoid body), dupa atasarea pe placi de cultura pretratate cu gelatina si in medii speciale inductoare, initieaza cascada diferentierii celulelor, cu obtinerea de zone pulsatile intr-o perioada scurta.
Efectuand aceste cercetari, am ajuns la concluzia ca, parametrii cu influenta specifica asupra diferentirii celulelor stem embrionare pe linie cardiaca sunt:
numarul initial de celule din corpusculii embrionari si modul de obtinere al acestora;
mediul de cultura;
tipul si numarul factoriilor de crestere; FCS; linia celulara utilizata.
1.4. CONCLUZII PARTIALE SI RECOMANDARI
In urma cercetarilor efectuate cu privire la diferentierea pe linie cardiaca a celulelor stem embrionare murine, obtinute de noi, putem sa concuzionam urmatoarele:
agregarea celulelor stem embrionare murine ca prima etapa foarte importanta a diferentierii in picatura suspendata folosind gravitatia ca o forta de agregare, permite obtinerea unor corpusculi embrionari calibrati;
agregarea celulelor ESCs prin utilizarea placilor cu aderenta scazuta a condus la obtinerea de corpusculi embrionari de dimensiuni foarte diferite cu margini neregulate, cu o mai slaba capacitate de aderare in etapele ulterioare ale cultivarii;
dupa 24 de ore de cultivare a corpusculilor embrionari obtinuti din picatura suspendata, pe placi gelatinizate s-a constatat atasarea unui numar de 85 (88,54%) de corpusculi embrionari, la 48, respectiv la 72 de ore s-a constatat un procent de atasare de 92,70% ;
la EBs din picaturi suspendate proveniti de la linia CDE1, s-au constatat aparitia contractiilor spontane dupa 7 zile de cultura (2+5d) intr-un procent de 52,80%;
rata contractiilor spontane din ariile de contractie prezinta o ascensiune cu inaintarea diferentierii, cu observarea unor platouri intre zilele 15 si 18 (78,65%), dupa care se observa o descrestere accentuata;
analiza statistica (TTEST-Origin 7) a procentajului EBS din linia CDE1 cu contractii spontane, a identificat existenta unor diferente statistic semnificative (p<0,005) in ceea ce priveste rata contractiilor pe cele doua substraturi de cultivare;
la EBs tratati cu BMP2 si BMP4 contactiile apar tardiv, in ziua 15-a diferentierii, datorita efectului inhibitor al BMP-4;
cele mai mici procente de contractii spontane s-au inregistrat in cazul EBS tratati cu IGF, 37,50%, desi la acesti corpusculi s-au inregistrat zonele de contractie cele mai mari;
zone cele mai mari de contractie s-au inregistrat
amestecarea factorilor de crestere duce la inhibarea si intarzierea contractiilor spontane in vitro;
am ajuns la concluzia ca, pe langa modul de obtinere a EBs, numarul initial de celule, mediul de cultura, factorii de crestere specifici, concentratia serului fetal si nu in ultimul rand linia celulara utilizata joaca un rol major in diferentierea in conditii optime a celulelor stem embrionare murine pe linie cardiaca;
analiza imunohistochimica prin utilizarea anticorpilor speciali ne-a permis identificarea celulelor precursoare cardiace si a celor dezvoltate in paralel dupa diferite strategii de inducere a diferentierii;
detectarea markerilor pluripotentei celulelor stem embrionare murine indica faptul ca, procesul de diferentiere celulara nu este ceva simultan la toate celulele din acelasi agregat ci se produce treptat, de aceea in cazul utilizarii acestor celule pentru transplant este imperios necesara sortarea lor pentru a preveni aparitia teratoamelor.
Recomandam utilizarea agregarii in hanging drops, sau picaturi verticale deoarece aceasta, fiind o metoda controlata, duce la obtinerea de corpusculi embrionari de aceleasi dimensiuni si cu caracteristici identice in etapele de cultivare ulterioare. Prin cunoasterea numarului initial de celulele agregate, experimentele pot fi oricand reproductibile pentru testari ulterioare. Corpusculii embrionari ofera avantajul unor structuri tri-dimensionale, care prin conglomeratul celular format intensifica interactiunile celula-celula, care se pare ca sunt importante in stadiile initiale ale diferentierii directionate.
Pe de alta parte complexitatea corpusculilor embrionari poate avea un dezavantaj, chiar major, prin secretia unor citokine si a unor factori necontrolabili care pot duce la o supraveghere mai putin precisa a diferentierii.
Bibliografie
- Anna M. Wobus, Kenneth R.B., 2005, Prospects for developmental biology and cell terapy, Physiol Rev. Bethseda 85:635-678;
- Agapios S., B.K. Fleischmann, E.Kollosov, Maria Wartenberg, H.Sauer, J. Hescheler, 2003, Cardiac specific differentiation of mouse embryonic stem cells, Cardiovascular Reserch, 58:278-291;
- Bagutti, C., Wobus, A.M., Fassler, R., and Watt, F.M., 1996, Differentiation of embryonal stem cells into keratinocytes: comparison of wild-type and β (1) integrin-deficient cells. Dev. Biol. 179, 184-196;
- Erghelegiu, Marina, 2005, Medicina regenerativa, Cadran Politic, Bucuresti;
- Evans M.J., Kaufman M.H., 1981 - Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156;
- Gocza Elen, 2004, Embrionalis ossejtek es ossejt vonalak, Magyar Tudomany, Budapest, 285-292;
- Gocza Elen, Lichner Zsuzsanna, Pall Emoke, Bontovics Babett, Bosze Zsuzsanna, 2008, Embrionális eredetű őssejt vonalak szerepe a differenciálodás során lejátszodo folyamatok mechanizmusainak tanulmányozásaban, Visegrad;
- Gócza Elen, Lichner Zsuzsanna, Páll Emőke, Bontovics Babett, Pouneh Maraghehechi , Bősze Zsuzsanna , 2008, A mir-290-295 őssejt specifikus mikro rns-ek, illetve őssejt specifikus transzkripciós faktorok expressziós mintázatának vizsgálata egér embrionális őssejt vonalakban, MBK Napok, Godollo, Hungary;
- Gossler, A., 1992, Early embryonic development of animals, Hennig, W., Nover, L., and Scheer, U. eds. (Berlin, New York: Springer-Verlag);
- Groza I., Ciupe Simona, D.D. Ciupercescu, Emőke Páll, Brandusa Stegeran, Daria Groza, 2006, Rescherches regarding the collection of mouse embryos and their use to obtain the stem cells, Buletin Simpozion Stintific, Bucuresti, pag.228-238;
- Groza I., D.D. Ciupercescu, Emőke Páll, Elen Gocza, 2006, In vitro production embryoid bodies from a mouse embryonic stem cell line and differentiation protocols towards cardiomyocyte and neuron lineages, Buletin Medicina Veterinara, Vol. 63, pag 264-269;
- Groza I., D.D. Ciupercescu, Emőke Páll, Elen Gocza, 2006, In vitro production embryoid bodies from a mouse embryonic stem cell line and differentiation protocols towards cardiomyocyte and neuron lineages, Buletin Medicina Veterinara, Vol. 63, pag 264-269;
- Groza, I., I. Morar, Andrologie veterinara, Ed. Gryphon, Brasov, 2004
- Groza, I., M. Muntean, Elemente de fiziologia reproductiei la animale, Ed. Academic Press, Cluj - Napoca, 2002;
- Groza, I., Simona Ciupe, Brindusa Stegeran, M. Cenariu, Daria Groza, 2006, Cercetari privind biotehnica procedurii embrionilor de soricioaica in vederea izolarii Celulelor Stem Embrionare, Simpozion FMV Iasi, volum in curs de editare;
16. Hescheler J., .K. Fleischmann, S. Lentini, V.A. Maltsev, J. Rohwedel, A.M. Wobus, K. Addicks, 1997 ; Embrionic stem cells: a model to study structural and functional properties in cardyomiogenesis; Elsevier Science - Cardiovascular Research 36, pag. 149 - 162;
- Lanza R.,2004, Handbook of Stem Cells, vol.1;
- Li SC, Wang L, Jiang H, Acevedo J, Chang AC, Loudon WG, 2008, Stem cell engineering for treatment of heart diseases: Potentials and challenges., Cell Biol Int.;
- Lichner Zsuzsanna Páll, Emőke, Gócza Elen, Bősze Zsuzsanna, 2006, miR-1 szerepe a szöveti elköteleződésben, MBK, Gödöllő;
- Lichner Zsuzsanna, Emoke Pall, Zsuzsanna Bosze, Elen Gocza, 2008, Investigation the role of stem cells specific MMU-MIR-290-295 Cluster, First International Conference of Functional Annotation of the Mammalian Genome, Rottach-Egern, Germany;
- Lichner Zsuzsanna,Emőke Páll, Zsuzsanna Bősze, Elen Gócza , 2008 , Overexpression of miR290-295 miRNA cluster in mouse ES, Transgenic Research Springer Netherlands, ISSN 0962-8819, Vol. 17 No. 5/oct. 2008, pag. 993-1023
- Madarasz Emilia, 2004, Az idegi ossejtek es lehetseges orvosi alkalmazasuk, Magyar Tudomany, Budapest, 351-364;
23. Martin G.R., 1981, Isolation of a Pluripotent Cell Line from Early Mouse Embryos Cultured in Medium Conditioned by Teratocarcinoma Stem Cells, Proc.Natl., Acad.Sci.USA, Vol 78. 12/7634-7638;
- Pal R., 2008, Embryonic stem (ES) cell-derived cardiomyocytes: A good candidate for cell therapy applications.Cell Biol Int.;
- Pall Emoke , Lichner Zsuzsanna, Bontovics Babett, Gocza Elen, 2008, Differentiation of embryonic stem cells: lessons from embryonic development,Scientifical papers USAMVB Timisoara, Animal Sciences and Biotechnologies, 2008, vol. 41(1), 130-137;
- Pall Emoke, Groza I., Irimie A., Ciupercescu D.D., Gocza Elen, 2007, Preliminary steps in production of mouse embryonic stem cell lines from mouse embryos , Revista Romana de Medicina Veterinara, Vol.3;
- Pall Emoke, Groza I., Soritau Olga, Catana Laura, Cenariu M., Modulation of cardiac differentiation of mouse embryonic stem cells under the influence of some growth factors, Lucrari stiintifice vol.51 (10), Medicina Veterinara, Ed. Ioan Ionescu de la Brad Iasi, pag.117-122;
- Robert L., John G., Brigid Hogan, Douglas M., Roger P., Donnall T.E., James T., Michael W., 2006, Essentials of Stem Cell Biology, Elsevier Academic Press, London, p. 265-349;
29. Robert P., Christine Mummery, 2005; Cardiomyocite differentiation from embrionic and adult stem cells; Current Opinion in Biotechnology 16; p. 498 - 502;
- Socaciu C., Boitor I., 1989, Model experimental de investigare a metabolismului energetic "invitro" la embrionii de soarece, Actualitati in patologia animalelor domestice, Vol.XV, Cluj-Napoca;
- Weissman I.L., 2000 - Stem cells: units of development, units of regeneration, and units in evolution. Cell. 100, 157-168.
- www.bdbiosciences.com;
- http://en.wikipedia.org/wiki/stem_cell;
- http://learn.genetics.utah.edu/units/stemcells;
- http://news.wisc.edu/packages/stemcells;
- http://www.scienceiionline.com;
- http://www.whoustuffworks.com.
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2025 - Toate drepturile rezervate -| |
|
|
|||
|
|||
|
|||
Referate pe aceeasi tema | |||
|
| |||
|
|||
|
|
|||