
| Biologie | Botanica | Chimie | Didactica | Fizica | Geografie |
| Gradinita | Literatura | Matematica |
Hidrologie
|
|
Qdidactic » didactica & scoala » geografie » hidrologie Probleme privind modelarea proceselor pentru tratarea apelor |
Probleme privind modelarea proceselor pentru tratarea apelor
PROBLEME PRIVIND MODELAREA PROCESELOR PENTRU TRATAREA APELOR
1. Problema consumului de oxigen (Biological Oxygen Demand ) si resursele sale
a) Materia organica deversata in sistemul acvatic este atacata de bacterii si descompusa in substante mai simple, folosind oxigen. De exemplu glucoza are BOD de 110mg/l, in concordanta cu reactia:
C6H12O6 + 6O2 ---> 6CO2 + 6H2O
Aceasta oxidare este terminata complet in mai putin de 5 zile. Pentru amestecul de compusi organici reactia va fi:
celule
COHN + O2 ---> CO2 + H2O + NH3 + celule
adica prin reactie (2) se creeaza o noua substanta bacteriala, care nu se degradeaza in 5 zile. Reziduurile domestice reprezinta o hrana bine echilibrata pentru microorganisme, precum tabelul (mg/l)
|
BOD5 |
|
|
N-total |
|
|
P-total |
|
b) Modelele mecanice inlatura materia in unul sau mai multe trepte, folosind gratare, camere cu nisip, sedimentare, filtrare, flotare. Ca exemple, in fig. a,b se dau doua tipuri de vase de sedimentare, primul pentru debite mici, al doilea pentru debite mari.

Fig.7
c) Procesele de tratare biologica se bazeaza pe utilizarea unor organisme, care au proprietati specifice: pot necesita energie radianta pentru crestere, necesita compusi organici ca nutrienti, folosesc donori (electroni) anorganici (de ex. gaz hidrogen), necesita oxigen molecular pentru crestere (ca oxidant), necesita sau nu oxigen din aer. Cele mai multe sisteme biologice de tratare a reziduurilor organice depind de organisme heterotrofice, care folosesc carbonul ca sursa lor de energie. Exista trei clase de metabolism cu reactii de oxidare: fermentare, respiratie aerobica (cu oxigen molecular) si respiratie anaerobica (fara oxigen). Aceste reactii se descriu prin procese.
Materie organica + O2 + NH3 + celule ---> CO2 + H2O + noi celule
Nitrificarea are 2 pasi: (1) amoniacul este oxidat in nitrit; (2) nitritul este oxidat in nitrati
2NH+4 + 3O2 ---> 2NO-2 + 2H2O + 4H+
2NO-2 + O2 ---> 2NO3
Operatia de denitrificare este:
2NO-2 + H2O ---> N2 + 2OH- + 5O
Nitratul se poate folosi ca o sursa de oxigen pentru procesele de descompunere biologica.
d) Sisteme de tratare mecanico-biologice, sunt foarte utilizate pentru reducerea BOD5 in ape municipale. Insa combinatii de metode fizice, chimice si irigatii sunt folosite si pentru ape industriale. Comparand, metodele chimico-fizice nu sunt sensibile la socuri de sarcina si la prezenta unor componente toxice, ele necesita un spatiu mai mic, ele permit recuperarea de grasimi, de proteine din industria alimentara, dar au un cost de investitie mai mare. Cele mai utilizate metode fizico-chimice de reducere a BOD sunt: precipitatie chimica, schimb ionic, adsorbtia si osmoza reversibila (ultima fiind scumpa).
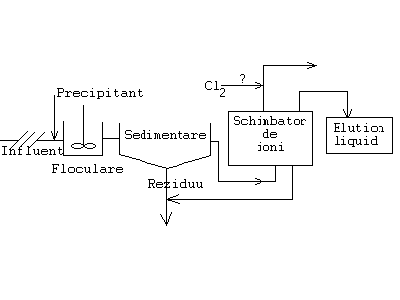
In fig.. 8. se da un exemplu de combinare a metodelor precipitarii chimice si a schimbului de ioni pentru tratare apelor uzate din industria alimentara, de exemplu un abator.
Comparativ se dau datele in diferite faze in mg/l:
|
|
Materie prima |
Dupa filtru biologic |
Dupa precipitare chimica cu glucoza |
Dupa schimb ioni |
||||
|
BDO5 |
|
|
|
|
||||
|
KMnO4 |
|
|
|
|
||||
|
N total |
|
|
|
|
||||
|
NH3-N |
|
|
|
|
||||
|
NO3-N |
|
|
|
|
||||
|
P |
|
|
|
|
Pentru apele uzate din industria alimentara se pot folosi irigari de suprafete agricole, dar trebuie acordata atentie adancimii solului pana la ape freatice (sa fie mare), continutului initial al apei in raport cu forma terenului (in panta se obsorb mai putine substante) si naturii solului (solul nisipos este mai filtrant, cel cleios nu).
Fig.8.
2.2. Recuperarea nutrientilor
Sursele de nutrienti in ape sunt date in tabel (mg/m2*an)
|
Pamant |
Fosfor |
Azot |
||
|
|
Igneous |
Sedimentar |
Igneous |
Sedimentar |
|
Padure |
|
|
|
|
|
Padure+pasuni |
|
|
|
|
|
Arii culturi agricole |
|
|
||
|
In apa de ploaie (mg/l) |
|
|
||
Fosforul poate fi recuperat prin precipitare chimica sau schimb de ioni, iar azotul prin nitrificare si denitrificare, schimb de ioni si ambele elemente prin alge in helestee.
a) Precipitarea chimica a compusilor de fosfor se face folosind sulfat de aluminiu (Al2(SO4)3, 18H20), hidroxid de calciu (Ca(OH)2) sau clorat de fier (FeCl3), dar trebuie examinata fiecare situatie separat.
De exemplu precipitarea fosfatilor folosind hidroxid de calciu se bazeaza pe formarea de Ca10(PO4)6(OH)2, care impune un pH mare, de 10.5 - 12.0. Acest fenomen este ilustrat in fig. 9., unde se prezinta dependenta eficientei precipitarii de pH, pentru principalii coagulanti folositi industrial.
Precipitare
(% )
pH

Fig.9
1 - sulfat de Al, 2 - clorat de fier, 3 - hidroxid de calciu
Punctat sunt prezentate aceleasi curbe pentru cazul prezentei ionilor de calciu, ceea ce arata complexitatea fenomenelor care au loc in epurarea apelor.
b) Nitrificarea si denitrificarea
Procesul de nitrificare inseamna oxidarea amoniacului
NH+4 + 2O2 ---> NO-3 + H2O + 2H+
Nitratii pot fi redusi cu bacterii heterotrofice, care insa necesita o sursa de carbon organic, de exemplu acetat:
5CH3COO- + 8NO3 ---> 4N2 + 7HCO-3 + 3CO2-2 + 4H20
Aceste procese depind de timpul de retinere.
c) Barbotare (stripping)
Procesul este folosit pentru a recupera gaze volatile, precum NH4, hydrogen sulphide, hydrogen cyanide, din apele uzate prin suflarea de aer. In fig. 10. se da ca exemplu constructia unui turn de barbotare. Deoarece aceste substante sunt acide, eficienta procesului va depinde de pH-ul solutiei. Dar gazele emise in atmosfera pot polua aerul:
NH+4 ---> NH3 + H+
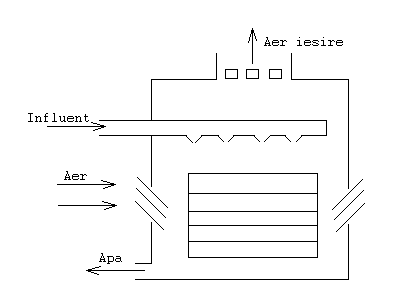
Fig.10
d) Clorurarea si adsorbtia pe carbune
Oxidarea amoniacului se face conform reactiilor:
Cl2 + H2O ---> HOCl + HCl
NH3 + HOCl ---> NH2Cl + H2O
NH2Cl + HOCl ---> NHCl2 + H2O
NHCl2 + HOCl ---> NCl3 + H2O
Adsorbtia pe carbune activat pentru cloramina este:
C + 2NHCl2 + H2O ---> N2 + 4H+ + 4Cl- + CO
Aceste reactii depind de puritatea carbonului.
e) Schimbul de ioni pentru recuperarea nutrientilor
Schimbul de ioni este un proces in care ionii de pe suprafata unui solid sunt schimbati cu ioni similar incarcati in solutia cu care solidul este in contact. Schimbul de ioni are ca scop sa se recupereze ionii nedoriti din ape uzate. Cationii (ioni pozitivi) sunt schimbati pentru hidrogen sau sodiu, ca de exemplu inlaturarea ionilor de calciu (Ca2+) ce cauzeaza duritatea apei.
H2R + Ca+2 ---> CaR + 2H+, unde R reprezinta o rasina.
Anionii (ionii negativi) se folosesc pentru ionii de hidroxid sau cloride. Selectivitatea in schimbul de ioni depinde de sarcina ionica, astfel selectia anionilor va fi in ordinea:
PO3-4 > SO2-4 > Cl-, iar pentru cationi
Al3+ > Ca2+ > Na+
f) Alge pentru lacuri
Pentru a scoate nutrientii cu alge se folosesc helestee. Pentru 100g. de masa uscata de fitoplancton, se obtin 4-10g. azot si 0.2-0.5g. fosfor. Dar metoda se poate folosi la tropice si subtropice, unde este suficienta energie solara intr-un an, unde se pot folosi suprafete mari de teren si nu sunt compusi organici in ape, ca de exemplu uleiuri.
2.. Recuperarea compusilor organici toxici
In general substantele toxice organice sunt scoase pana la deversarea apelor uzate in sistemul municipal. Pentru scoaterea lor se folosesc:
separatoare pentru uleiuri
flocularea pentru coloidale organice
flotarea pentru impuritati cu greutate specifica mai mare ca 1
adsorbtia, pentru insecticide pe carbon activat
sedimentarea, impreuna cu precipitarea chimica
oxidarea si reducerea pentru cyanide, chlormate, folosind aer si O2
distilarea, pentru ape radioactive, pentru ca este scumpa
filtrarea pentru suspensii materiale in volume reduse de apa
neutralizarea, cand trebuie deversate solutii cu pH=6-8, folosind neutralizanti ca hidroxid de calciu, H2SO4 si CO2
2.4. Recuperarea metalelor (grele)
Metalele grele sunt vatamatoare in ecosisteme. Scoaterea lor prin procedee mecanice are o eficienta de 30-70%, nu poate fi folosita tratarea biologica, acestea fiind exemple de inhibatori. Pentru recuperare se pot folosi metodele: precipitarea chimica, extractie si osmoza reversibila.
Ca exemplu se da scoaterea cromatului din ape uzate care poate fi sub forma CrO3; Na2Cr2O7*2H2O. Agentii folositi pentru oxidare sunt sulfati de fier, sulphur dioxide, dupa reactiile:
CrO3 + H2O ---> H2CrO4
2H2CrO4 + 6FeSO4 + 6H2SO4 ---> Cr2(SO4)2 + 3Fe2(SO4)3 + 8H2O
Cr2O2-7 + 6FeSO4 + 7H2SO4 ---> Cr2(SO4)3 + 3Fe2(SO2)3 + 7H2O + SO2-4
Prin sedimentare se inlatura din apa substantele nocive.
Ca exemplu de folosire a metodei schimbului de ioni se da folosirea cationilor pentru scoaterea ionilor de metal, ca Fe2+, Fe3+, Cr3+, Al3+, ZN2+, Cu2+.
2.5. Resursele de apa
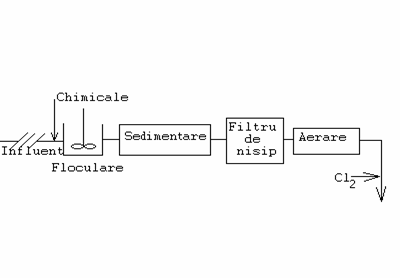
Omul nu poate sa existe fara apa. Apele subterane sunt mai bune ca apele de suprafata, dar ele pot contine Fe si Mn. Nu toate apele necesita un ciclu complet de pretratare si tratare. De exemplu pentru apele de suprafata este suficient ciclul din fig. 11 :
Fig.11
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Duritatea apei poate fi inlaturata prin fierbere
Duritatea apei poate fi inlaturata prin fierbere
Ca(HCO3)2 ---> CaCO3 + CO2 + H2O
duritatea se poate datora si Mg in Mg(HCO3)2.
Apa trebuie supusa si dezinfectiei, folosind agenti chimici ca ozonul, chlorine dioxide si chlorine, care provoaca o degradare chimica a materiei celulare, inclusiv enzime, in timp ce prin fierbere se distrug fizic microorganismele. Dar microorganismele sunt omorate de conditiile de pH, mai jos de 0 si mai sus de 11.0. Razele X si gamma, de lungimi de unda scurta au capacitatea de a distruge microorganismele. Ca exemplu, in fig.12 se da procentul de distrugere al unor bacili in functie de combinatia de ozon O3 si Cl2, realizandu-se astfel dezinfectia apei.

Fig.12
| Contact |- ia legatura cu noi -| | |
| Adauga document |- pune-ti documente online -| | |
| Termeni & conditii de utilizare |- politica de cookies si de confidentialitate -| | |
| Copyright © |- 2026 - Toate drepturile rezervate -| |
|
|
||||||||
|
||||||||
|
||||||||
Proiecte pe aceeasi tema | ||||||||
|
| ||||||||
|
||||||||
|
|
||||||||








